А1. общая формула алканов: 1) сn h2n 3) cnh2n-2 2) cnh2n+2 4) cnh2n-6 а 2. название вещества, формула которого сн3─сн(сн3)─сн(он)─сн3 1) бутанол-2 3) 2-метилбутанол-3 2) пентанол-2 4) 3-метилбутанол-2 а 3. вид гибридизации электронных орбиталей атома углерода, обозначенного звёздочкой в веществе, формула которого сн3─с∗≡сн 1) sp3 3) sp 2) sp2 4) не гибридизирован а 4. число σ-связей в молекуле этилена равно: 1) 6 3) 5 2) 2 4) 4

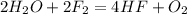
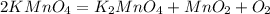
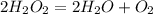
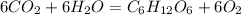
А2. 4)
А3. 2)
А4. 1)