А здесь так:
NaOH + HCl = NaCl + H2O;
H2SO4 + Zn = ZnSO4 + H2;
KOH + MgO <=> Реация не идёт, поскольку основание с основным оксидом не реагирует. НЕ СОГЛАСЕН с "Лапули4ка". Извини, но у тебя неправильно...
Ba(OH)2 + CO2 = BaCO3 + H2O => выпала соль в осадок - Карбонат Бария;
SO2 + P4O10 = H2O + H2SO4 + PH3 (Написал P4O10, потому что уравнивать не охото=)) Но реация верная, поскольку формула P2O5 - очень условная, правильная P4O10. Прочитай Рудзитиса за 10 класс (Азот и Фосфор).
The end?
126 000 г х л, у г
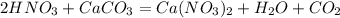
126 г 22,4 л
1. Найдем теоретически возможный объем углекислого газа:
при взаимодействии 126 г кислоты выделяется 22,4 л углекислого газа, а
при -- // -- // -- 126 000 г______________х л, откуда
х=126000*22,4/126=22 400 л
2. Найдем массу углекислого газа:
Если 44 г углекислого газа занимает объем 22,4 л, то
у г________________________________22 400 л, откуда
у=44*22400/22,4=44 000 г или 44 кг
ω(H₂SO₄)=20%=0.2
ω(NaOH)=4%=0.04
Найти:
m(р-раH₂SO₄):m(р-раNaOH)-?
Решение:
Возьмем массу раствора H₂SO₄ за 100г.Аналогично возьмем раствор NaOH за 100г.Тогда:
m(H₂SO4)=100*0.2=20г
m(NaOH)=100*0.04=4г
Раз раствор гидроксида натрия полностью нейтрализовал раствор серной кислоты,то должно выполнятся равенство:
n(H₂SO₄)=2*n(NaOH)
Рассчитаем химические количества:
M(H₂SO₄)=98г/моль
M(NaOH)=40г/моль
n(H₂SO₄)=m/M=20/98≈0.2моль
n(NaOH)=m/M=4/40=0.1моль
Т.к. серной кислоты 0.2моль,а гидроксида натрия 0.1моль ,то для полной нейтрализации нужно еще 0.3моль гидроксида натрия т.е. иными словами мы должны взять не 100г раствора,а 400г раствора гидроксида натрия.
Составляем соотношение:
m(р-раH₂SO₄):m(р-раNaOH)=100:400=1:4
ответ: 1:4