Исходя из закона сохранения массы, можно составлять уравнения химических реакций и по ним производить расчеты. Он является основой количественного химического анализа.
Составление химических уравнений.
Включает три этапа:
1. Запись формул веществ, вступивших в реакцию (слева) и продуктов реакции (справа) , соединив их по смыслу знаками "+" и "-->" :
HgO --> Hg + O2
2. Подбор коэффициентов для каждого вещества так, чтобы количество атомов каждого элемента в левой и правой части уравнения было одинаково:
2HgO --> 2Hg + O2
Объяснение:
ответ: 52.8грамм
Объяснение:
Есть известь негашеная - CaO (оксид кальция II)
А есть гашеная - Ca(OH)2 (гидроксид кальция)
Также есть известь как материал - CaO и MgO
Процесс нагревания означает реакцию разложения, то есть в выходе будут только те атомы, которые были в исходных продуктах. А во всех предложенных известях нет углерода, поэтому углекислый раз в принципе не образуется. Поэтому задача нерешаема.
НО есть известь воздушная или же мел - CaCO3, который уже подходит и делает реакцию
CaCO3→СаО+СО2↑
Если идти так, то задача крайне тривиальна, так как количество молей углекислого газа и извести совпадает. То есть n(CaCO3)=n(CO2)
n(CaCO3)=m(CaCO3)/M(CaCO3)
m(CO2)=n(CO2)*M(CO2)=n(CaCO3)*M(CO2)=m(CaCO3)/M(CaCO3)*M(CO2)=
=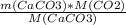 =
= =52.8 г.
=52.8 г.
Дано:
m(CaCO3)=120г.
Найти: m(CO2)
Решение расписал
H+OH= H2O
K2CO3+H2SO4= K2SO4+CO2+H2O
CO3+2H= CO2+H2O