1. соль двухвалентного железа и соляной кислоты. если у атома железа валентность 2, то у 2х атомов хлора по 1 на каждый
2. соляная кислота. у водорода постоянная валентность 1, у хлора значит тоже 1
3. хлористый алюминий. тут хлор имеет валентность 1, значит железо 3х валентное
4. оксиген всегда 2х валентный, значит у азота валентность 2*2=4
5. оксиген всегда 2х валентный,значит у меди валентность 2
6. кальций всегда 2х валентный,значит у хлора валентность 1 на каждый атом
7. оксиген всегда 2х валентный,значит у свинца тоже валентность 2
8. оксиген всегда 2х валентный,значит у хрома валентность 6/2=3
9. водород всегда 1-валентный, значит у серы валентность 2
10. оксиген всегда 2х валентный,значит у хрома валентность 2*3=6
В большинстве случаев валентность и степень окисления численно совпадают
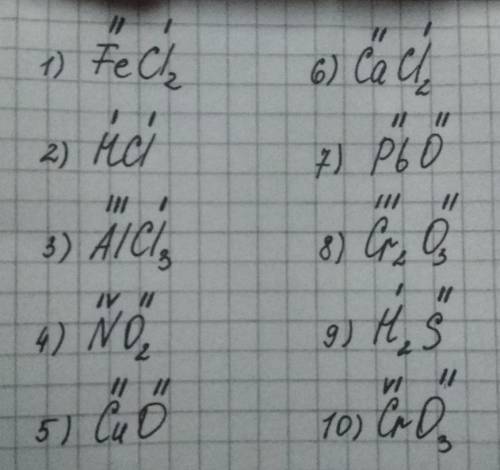
Объяснение:
Привет! Тут все очень просто,
Азотная кислота - бесцветная, дымящая на воздухе жидкость.
Она сильный электролиз и разлагается при нагревании на NO2 ,O2 , H2O.
ответ A1: 2
Фосфор может взаимодействовать с Ca ,обычная реакция двух простых веществ: 3Ca + 2P = Ca3P2
ответ A2: 1
Ядовитой аллотропной модификацией фосфора является белый фосфор, т.к. он имеет молекулярную решетку и поэтому химически очень активный.
ответ A3: 3
Обычно степень окисления P с металлами равна -3 (Это просто нужно знать)
ответ A4: 1
Атом фосфора в отличие от атома азота имеет больший атомный радиус ,т.к. в таблице Менделеева атомный радиус увеличивается справа налево и сверху вниз.
ответ A5: 1
Ортофосфорная кислота (H3PO4) - кислота средняя, которая может реагировать с металлами до H2. Реакция с Cu не идёт ,т.к. в ряду активности металлов она стоит после H2. С остальными пойдет,т.к. Fe до H2 , а остальное оксиды.
ответ A6: 2
Металл средней активности (Zn) с реакцией с HNO3 (конц.) будет давать NO2 ,т.к. молекул кислоты много,а Zn мало.
Cu - неактивный металл и будет давать с HNO3 (разб.) - NO
Zn с HNO3(разб.) будет давать N2O ,т.к. молекул HNO3 мало и азот будет восстанавливаться до N^+1
Mg с HNO3 (оч.разб.) будет давать N2 , т.к. Mg более активный чем Zn (Mg в ряду активности стоит почти рядом с Щелочными металлам) и + HNO3 (очень разбавленная) ,т.е. в растворе очень мало молекул HNO3 ,т.е. N будет восстанавливаться в N^0
ответ A7: 3421
1)
4NH3 + 5O2 = 4NO + 6H2O
n(NH3) = V(NH3)/Vm = 11,2/22,4 = 0,5 моль
По уравнению n(NO) = n(NH3) = 0,5 моль.
2)
N2 + 3H2 = 2NH3
Для газов отношения количества моль равны отношению объемов. Поэтому:
V(NH3) = 2*V(N2) = 112 л - это теоретически возможный объем.
На практике же получили: 112*0,5 = 56 л,
n(NH3) = V(NH3)/Vm = 56/22,4 = 2,5 моль
m(NH3) = n(NH3)*M(NH3) = 2,5*17 = 42,5 г.
3)
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
n(NH4Cl) = m(NH4Cl)/M(NH4Cl) = 20/53,5 = 0,37 моль
n(Ca(OH)2) = m(Ca(OH)2)/M(Ca(OH)2) = 20/74 = 0,27 моль
По уравнению n(NH4Cl):n(Ca(OH)2) = 2:1. Имеем: 0,37:0,27 = 1,4:1. Значит хлорид аммония в недостатке, он прореагирует полностью, по нему и считаем.
По уравнению:
n(NH3) = n(NH4Cl) = 0,37 моль
V(NH3) = n(NH3)*Vm = 0,37*22,4 = 8,288 ~ 8,3 л.
4)
2NH3 + H2SO4 = (NH4)2SO4
n(NH3) = V(NH3)/Vm = 134,4/22,4 = 6 моль
По уравнению:
n(H2SO4) = n(NH3)/2 = 6/2 = 3 моль
m(H2SO4) = n(H2SO4)*M(H2SO4) = 3*98 = 294 г
m(p-paH2SO4) = m(H2SO4)/W(H2SO4) = 294/0,78 = 377 г = 0,377 кг.