Объяснение:
1) Жиры — органические вещества, продукты этерификации карбоновых кислот и трёхатомного спирта глицерина.
2) Глицерин.
3) В состав молекул жиров входят остатки высших карбоновых кислот: стеариновой C 17 H 35 COOH , пальмитиновой C 15 H 31 COOH , олеиновой C 17 H 33 COOH .
4) Да, это смесь сложных эфиров глицерина и высших жирных кислот (ВЖК)
5) Физико-химические и химические свойства жиров
6) При нагревании, кроме растительного оно и про комнатной температуре жидкое
7) Жидкие жиры растительного происхождения называются маслами и представляют собой сложные эфиры глицерина и высших непредельных кислот .
8) Все жиры животного происхождения - твёрдые вещества. Исключение лишь составляет рыбий жир
9) Жиры практически нерастворимы в воде, хорошо растворимы в органических растворителях
10)
11) Иодное число — масса иода (в г), присоединяющегося к 100 г органического вещества.
12) При омылении жиров
13) При длительном хранении под действием влаги, кислорода воз- духа, света и тепла непредельные жиры приобретают неприятный запах и вкус. Этот процесс называется прогорканием
14) Жидкие жиры можно перевести в твердые путем реакции гидрогенизации
15) С пищевым жиром организм получает жирорастворимые витамины А, Д, Е, К, незаменимые жирные кислоты, фосфатиды, холестерин, холин
16)
17) Жиры, также триглицериды, триацилглицериды
18) Это соли жирных кислот, обладающие моющими свойствами
19) В зависимости от того, какие соли (натриевые или калиевые) применяются при производстве, получается либо твёрдое мыло, либо жидкое
20)
Спирты: Метанол (CH3OH), Этиленгликоль (C2H6O2), Бутанол (C4H9OH), Глицерин (C3H8O3)
Альдегиды: Этаналь (C2H4O), Метаналь (HCHO), Пропаналь (СН3СН2СHO)
Карбоновые кислоты: Уксусная кислота (CH3COOH), Муравьиная кислота (HCOOH), Этановая кислота (CH3COOH)
Сложные эфиры: Метиловый эфир уксусной кислоты (CH3COOCH3)
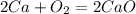
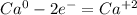 ·2 восстановитель полуреакция окисления
·2 восстановитель полуреакция окисления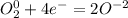 ·1 окислитель полуреакция восстановления
·1 окислитель полуреакция восстановления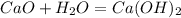
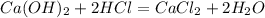
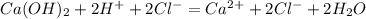
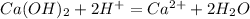
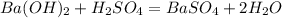
![m[Ba(OH)_2]=](/tpl/images/0276/7725/752a4.png) =50 · 0,18 = 9 г
=50 · 0,18 = 9 г![n[Ba(OH)_2]= \frac{m[Ba(OH)_2]}{M[Ba(OH)_2]} = \frac{9}{171} =0,0526](/tpl/images/0276/7725/43f28.png) моль
моль![n(BaSO_4)=n[Ba(OH)_2]=0,0526](/tpl/images/0276/7725/a4a1c.png) моль
моль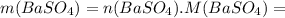 =0,0526 · 233=12,2558 г ≈12,26 г
=0,0526 · 233=12,2558 г ≈12,26 г
m(CaS с прим.)=20г.
ω%(CaS от теор.возм.)=80%
Найти: m(Ca(OH)₂-?
1. Определим ТЕОРЕТИЧЕСКИЙ выход сульфида кальция:
ω% = m(в-ва)÷m(смеси)×100%, отсюда:
m(в-ва)=ω% ×m(смеси)÷100%
m(CaS)=80%×20г.÷100%=16г.
2. Определим молярную массу сульфида кальция:
M(CaS)=40+32=72г./моль.
3. Определим количество вещества сульфида кальция в 16г.:
n=m÷M n(CaS)= n(CaS)÷M(CaS)=16г÷72г./моль=0,22моль
4. Запишем уравнение реакции взаимодействия гидроксида кальция с сероводородной кислотой:
Ca(OH)₂ + H₂S = CaS + 2H₂O
5. Анализируем уравнение реакции: по уравнению реакции на получение 1моль сульфида кальция расходуется 1моль гидроксида кальция, значит, если по условию, задачи образовалось 0,22моль сульфида кальция, то расходуется тоже 0,22моль гидроксида кальция. n[(Ca(OH)₂] =0,22моль
6. Определяем молярную массу гидроксида кальция:
M[Ca(OH)₂]= 40+16+1x2=58г./моль
7. Определяем массу гидроксида кальция количеством вещества 0,22моль:
n=m÷M, отсюда m=n xM
m[Ca(OH)₂]=n[Ca(OH)₂] xM[Ca(OH)₂]=0.22мольх58г./моль=12,76г.
8. ответ: на получение 16г. сульфида натрия израсходовалось 12,76г. гидроесида кальция.