Дано:
m(p-pa KOH)= 100 г
ω(KOH) = 30% или 0,3
m(p-pa HNO3) = 100 г
ω(HNO3) = 30% или 0,3
Найти:
m(KNO3)-?
Решение.
m(KOH) = m(p-pa KOH)*ω(KOH) = 100 г*0,3 =30 г
М(КОН) = 56 г/моль
n(KOH) = m/M = 30 г/56 г/моль = 0,5357 моль
m(HNO3) = m(p-pa HNO3)*ω(HNO3) = 100 г*0,3 = 30 г
M(HNO3) = 63 г/моль
n(HNO3) = m/M = 30 г/63 г/моль = 0,47619 моль
M(KNO3) = 101 г/моль
KOH + HNO3 = KNO3 + H2O
Из УХР видно, что n(KOH):n(HNO3) = 1:1, согласно расчетам по данным задачи n(KOH):n(HNO3) = 0.5357:0,47619 = 1.125:1, следовательно, КОН взят в избытке; из УХР видно, что n(KNO3)=n(HNO3) = 0,47619 моль
m(KNO3) = n*M = 0,47619 моль*101 г/моль = 48,1 г
ответ: 48,1 г
Задача 14: 3.76 грамм
Задача 16: 0.8 к 1.8 или 1 к 2.25
Объяснение:
Задание 14:
Mr[Cu(NO3)2] = 188 г/моль
Число атомов: 1Cu + 2N + 6O = 9 атомов всего
N (A) = 9 × 6.02 × 10^23 = 54.18 × 10^23 атомов
N(A) = 1.0835 × 10^23 атомов
m[Cu(NO3)2] = ?
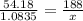
x= 3.76 грамм
m[Cu(NO3)2] = 3.76 грамм
ответ: 3.76 грамм
Задание 16:
Ca3(PO4)2
Mr(соли) = 310 грамм/моль
n(P) = 2 моль атомов фосфора в составе 1 моли соли
m(соли) = 124 грамм
n(соли) = m/Mr = 124/310 = 0.4 моли
n(P) = 2 × 0.4 = 0.8 моль Фосфора в составе соли массой 124 грамма
Al(NO3)3
Mr(соли) = 213 грамм/моль
n(N) = 3 моль атомов азота в составе 1 моли соли
m(соли) = 127.8 грамм
n(соли) = m/Mr = 127.8 / 213 = 0.6 моли
n(N) = 3 × 0.6 = 1.8 моль азота в составе соли массой 127.8 грамм
Соотношение:
n(P) = 0.8
n(N) = 1.8
0.8 к 1.8
или
1 к 2.25
д)3NaOH+H3PO4=Na3PO4+3H2O
е)NaOH+CO2=NaHCO3
Только 3 реакции идут