Практична роботавластивості етанової кислоти: завдання 1. дослідіть дію етанової кислоти на індикатори.опишіть та зробіть висновкизавдання 2. здійсніть реакцію взаємодії етанової кислоти з магнієм.опишіть та зробіть висновкизавдання 3. дослідіть взаємодію етанової кислоти з лугами.опишіть та зробіть висновкизавдання 4. дослідіть взаємодію етанової кислоти із солямибудь-ласка розвяжіть це мені на завтра
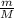 =
= 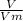
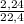 = 0,1 моль
= 0,1 моль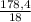 = 9,91 моль
= 9,91 моль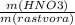 * 100%
* 100% 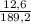 * 100% = 6,66%
* 100% = 6,66% 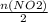
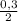 = 0,15 моль
= 0,15 моль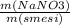 * 100%
* 100% 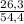 * 100% = 48,257 %
* 100% = 48,257 %
Дослід 1. Досліджували дію етанової кислоти на індикатори. В першій пробірці розчин набуває червого кольору, в другій - рожевого.
Рівняння дисоціації етанової кислоти:
CH3COOH ↔ CH3COO-+ + H+
Зміна забарвлення індикаторів свідчить про кисле середовище, що
створюється завдяки електролітичній дисоціації етанової кислоти
Дослід2.Під час взаємодії етанової кислоти з магнієм виділився водень об’ємом 44,8 л (н.у.). Обчисліть масу етанової кислоти, що прореагувала.
Відомо: V(H2)=44,8 л. Знайти: m(CH3-COOH)-?
Розв'язування б
Записуємо рівняння реакції:
х г 44,8 л
2CH3-COOH + Mg → (CH3-COO)2Mg + H2↑
120 г 22,4 л
Над формулами речовин записуємо дані, що є за умовою задачі.
Мольні співвідношення речовин показують коефіцієнти рівняння.
Прореагувало 2 моль етанової кислоти CH3-COOH з утворенням 1 моль водню Н2 (1 моль газу за н.у. займає об'єм 22,4 л). Обчислюємо молярну масу (M=Mr г/моль) етанової кислоти й, відповідно, масу 2 моль.
Mr(CH3-COOH)=2•Ar(C)+4•Ar(H)+2•Ar(O)=2•12+4•1+2•16=60,
M(CH3-COOH)=60 г/моль. Маса 1 моль=60 г, а маса 2 моль=120 г.
Відповідні значення записуємо під формулами речовин у рівнянні реакції.
За до пропорції обчислюємо масу етанової кислоти.
х г / 120 г = 44,8 л / 22,4 л, звідси
х г • 22,4 л = 120 г • 44,8 л
х = 120 г • 44,8 л : 22,4 л
х=m(CH3-COOH)=240 г б
Обчислюємо кількість речовини водню об'ємом 44,8 л за формулою v=V/VM, де VM-постійна величина і за н.у. чисельно дорівнює 22,4 л/моль.
v(Н2)=V(Н2) : VM=44,8 л : 22,4 л/моль=2 моль
Записуємо рівняння реакції: 2CH3-COOH+Mg→(CH3-COO)2Mg+H2↑
Мольні співвідношення речовин показують коефіцієнти рівняння.
Прореагувало 2 моль етанової кислоти CH3-COOH з утворенням 1 моль водню Н2, кількість речовини етанової кислоти удвічі більша, ніж кількість речовини водню, тому
v(CH3-COOH)=2•v(Н2)=2•2 моль=4 моль
Обчислюємо масу етанової кислоти кількістю речовини 4 моль за формулою m=v•M, де
M=Mr г/моль.
Mr(CH3-COOH)=2•Ar(C)+4•Ar(H)+2•Ar(O)=2•12+4•1+2•16=60,
M(CH3-COOH)=60 г/моль.
m(CH3-COOH)=v(CH3-COOH)•M(CH3-COOH)=4 моль • 60 г/моль=240 г
Відповідь: 240 г CH3-COOH.
Дослід3.Досліджували взаємодію етанової кислоти з лугами. Колір індикаторів кислого середовища зникає, вони набувають кольору нейтрального середовища: лакмус стає фіолетовим,метилоранж -оранжевим . СH3COOH + NaОН → CH3COONa + H2О
CH3COOH+Na+ОН-→ CH3COO-+Na+H2О
CH3COOH+ОН-→ CH3COO-+H2О Взаємодія етанової кислоти з лугами є реакцією нейтралізації, утворюється сіль і вода
Досліджували взаємодію етанової кислоти з солями. Суміш "вскипає’’
CH3COOH + NaНСО3 →CH3COONa + Н2О+ СО2↑
CH3COOH+Na++НСО3-→CH3COO-+Na++Н2О+СО2↑
CH3COOH+НСО3-→CH3COO-+Н2О+СО2↑
Етанова кислота взаємодіє з солями слабших кислот (солями-карбонатами)