Дано:
m(солей) = 1 кг = 1000 гр
V(р-ра AgNO₃) = 1 л = 1000 мл
ω(AgNO₃) = 8%
ρ(р-ра AgNO₃) = 1,07 гр/мл
----------------------------------------------------
Найти:
ω(NaCl) - ? ω(NaBr) - ?
1) Для начала мы запишем два уравнения реакций:
NaCl + AgNO₃ → AgCl↓ + NaNO₃
NaBr + AgNO₃ → AgBr↓ + NaNO₃
2) Далее мы находим массу раствора нитрата серебра, а потом его находим массу нитрата серебра без раствора:
m(р-ра AgNO₃) = V(р-ра AgNO₃) × ρ(р-ра AgNO₃) = 1000 мл × 1,07 гр/мл = 1070 гр
m(AgNO₃) = m(р-ра AgNO₃)×ω(AgNO₃)/100% = 1070 гр × 8%/100% = 1070 гр × 0,08 = 85,6 гр
3) Далее находим количество вещества у нитрата серебра:
M(AgNO₃) = 108+14+16×3 = 122+48 = 170 гр/моль
n(AgNO₃) = m(AgNO₃)/M(AgNO₃) = 85,6 гр / 170 гр/моль ≈ 0,504 моль
4) Далее мы составляем уравнение чтобы найти массу каждой соли:
Пусть m(NaCl) = m(NaBr) = x гр, тогда количество вещества солей будет:
M(NaCl) = 23+35,5 = 58,5 гр/моль M(NaBr) = 23+80 = 103 гр/моль
n(NaCl) = m(NaCl)/M(NaCl) = x гр / 58,5 гр/моль = x/58,5 моль
n(NaBr) = m(NaBr)/M(NaBr) = x гр / 103 гр/моль = x/103 моль
5) Следовательно количество веществ у нитрата серебра из уравнений реакций будет вот так получаться:
n₁(AgNO₃) = n(NaCl) = x/58,5 моль
n₂(AgNO₃) = n(NaBr) = x/103 моль
6) Теперь мы составляем уравнение для того чтобы найти массу каждой соли:
n₁(AgNO₃) + n₂(AgNO₃) = n(AgNO₃)
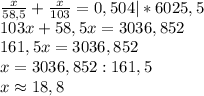
Значит: m(NaCl) = m(NaBr) = 18,8 гр
7) Теперь мы находим массовые доли обеих солей, мы знаем в условий сказано что массовые доли солей в растворе одинаковы, значит мы получим вот такой результат:
ω(NaCl) = m(NaCl)/m(солей) × 100% = 18,8 гр / 1000 гр × 100% = 0,0188 × 100% = 1,88% ⇒ ω(NaCl) = ω(NaBr) = 1,88%
ответ: 4) 1,88% , 1,88% (ω(NaCl) = ω(NaBr) = 1,88%)
Объяснение:
Метали — клас хімічних елементів і речовин з такими хімічними та фізичними властивостями:
добре проводять електричний струм і тепло,
непрозорі, але здатні відбивати світло (мають металічний блиск),
ковкі, що дозволяє надавати виробам з них потрібної форми та розвальцьовувати їх,
пластичні, що дає можливість витягати їх у тонкий дріт.
за участі у хімічних реакціях є донорами електронів (віддають електрони).
Сплав — тверда або рідка однорідна речовина, утворена сплавленням (стопленням) кількох металів або металів з неметалами. Всі сплави, як і метали, у твердому стані зазвичай мають кристалічну будову.
Корозія металів — самопливне руйнування металів і сплавів, а також інших речовин у результаті хімічної взаємодії з навколишнім середовищем.
Элемент с порядковым №15 находится в 3 периоде 5 группе, главной подгруппы. Атомная масса=31.Заряд ядра атома Р+15,т. к. в ядре находится 15 протонов, а их число равно порядковому №. В ядре атома нах. 16 нейтронов (Количечтво нейтронов=атомная масса-колличество протонов) . В атоме нах. 15 электронов, т. к. их число равно числу протонов и порядковому номеру. В атоме фосфора 3 электронных слоя, т. к. Р стоит в 3 периоде. На последнем слое нах. 5 электронов, т. к. фосфор стоит в 5 группе. Последний слой не завершен. Р-неметалл, т. к. в хим. реакции с металлами принемает 3 электрона до зовершения слоя. Его оксид Р2О5-кислотный. Он взаимод. с Н2О, основаниями и основными оксидами. Его гидроксид Н3РО4-кислота. Она взаимод. с металлами, стоящими до Н (водорода), с основными оксидами, основаниями.
1. К - элемент I группы главной подгруппы, у него ВСЕГДА на внешнем уровне 1 электрон, соответственно и степень окисления +1 (ему легче этот электрон отдать, чем 7 электронов принять) . К ВСЕГДА обладает свойствами щелочных металлов (это типичный металл) , значит он может образовывать ТОЛЬКО основные оксиды, формула высшего оксида К2О (общая формула высших оксидов находится в самом низу таблицы Менделеева под каждой группой, там вместо R в формуле подставляете элемент нужный, а все индексы сохраняете)
Соответственно, свойства основных оксидов:
а) реакция с водой
К2О + Н2О = 2КОН
б) с кислотами
К2О + Н2SO4 = K2SO4 + H2O
в) с амфотерными основаниями
3К2О+ 2Al(OH)3 = 2K3AlO3 + 3H2O
г) с кислотными оксидами
К2O + CO2 = K2CO3
2. гидроксид калия - щелочь (тривиальное название - едкое кали) - КОН