27 г у л
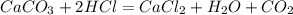
100 г 22,4 л
1.Определим чистую массу карбоната кальция в известняке:
30 г известняка - это 100%, а
х г________________90%, откуда х=30*90/100=27 г
2. По этой массе,подставив ее в уравнение реакции,и определим объем углекислоо газа:
при взаимодействии 100 г карбоната образуется 22,4 л углекислого газа, а
при --//--//-- 27 г___________________у л, откуда
у=27*22,4/100=приблизительно 6 л
Не сложная задачка.
Уранения реакций:
HCOOC2H5 + NaOH = HCOONa + C2H5OH
CH3COOC2H5 + NaOH = CH3COONa + C2H5OH
Рассчитаем количество вещества гидроксида натрия:
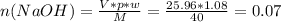 моль
моль
Пусть в реакцию вступает х моль этилового эфира муравьиной кислоты
Пусть в реакцию вступает у моль этилового эфира уксусной кислоты
Тогда, массу смеси эфиров можно математически представить как следующее выражение:
74х + 88у = 5,6 , здесь 74 - молярная массу уксусного эфира, 88 - молярная масса уксусного эфира уксусной кислоты
По уравнению реакции:
n(NaOH) = n(HCOOC2H5) = х моль
n(NaOH) = n(CH3COOC2H5) = у моль
Составим систему уравнений:
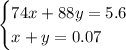
Домножим второе уравнение системы на 74, получим:
74x + 88y = 5.6
74x + 74y = 5.18
Вычтем из первого уравнения второе:
14y = 0.42
y = 0.03
х = 0,07 - 0,03 = 0,04
Рассчитаем массу уксуснометилового эфира:
m = n*M = 0,04*74 = 2,96г
Рассчитаем массу уксусноэтилового эфира:
m = n*m = 0,03*88 = 2,64г
S = 25г/100г н₂о
mдоб. = 8 г
mк.г. = 32 г
Найти: w(с/к.г).
Решение:
1) Переведем растворимость S в массовые доли wнас.
Если 25 г растворяется в 100 г воды, то wнас. = 25/(25+100) = 0,2
2) Добавили 8 г соли и нагрели.
Пусть у нас было m г насыщенного раствора с wнас=0,2, тогда соли в нем было 0,2m
После добавления и нагревания стало: (0,2m+8) г соли
в (m+ 8) г горячего раствора.
3) После охлаждения до прежней температуры выпало 32 г кристаллогидрата.
Пусть безводной соли в кристаллогидрате содержится w(с/к.г), тогда:
w(c/к.г.)*32 г масса безводной соли в выпавшем кристаллогидрате.
(0,2m + 8 - w(с/к.г)*32) г осталось соли в насыщенном растворе
(m + 8 - 32) = (m - 24) г осталось раствора
4). Поскольку раствор охладили до той же температуры, при которой растворимость (и массовая доля растворенной соли) прежняя, составим и решим уравнение:
0,2 = (0,2m + 8 - w(с/к.г.)*32)/(m-24)
0,2m - 4,8 = 0,2m + 8 - w(с/к.г.)*32
w(с/к.г)*32 = 12,8
w(с/к.г.) = 12,8/32 = 0,4 = 40 %
ответ: 0,4 (или 40%) массовая доля безводной соли в выпавшем кристаллогидрате.