 такая реакция невозможна, поскольку условием при прохождении реакции обмена должен образоватья газ или слабый электролит или осадок. В данной реакции мы этого не видим.
такая реакция невозможна, поскольку условием при прохождении реакции обмена должен образоватья газ или слабый электролит или осадок. В данной реакции мы этого не видим.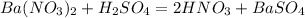 (условие неправильно записано: не
(условие неправильно записано: не 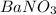 , а
, а 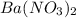 )
) (протекает при 600-700°C, реакция идет с
(протекает при 600-700°C, реакция идет с 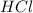 в газовом состоянии, а не с жидким
в газовом состоянии, а не с жидким 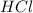 ), либо:
), либо:![2Cu+4HCl=2H[CuCl_2]+H_2](/tpl/images/0458/5320/5b6fa.png) (с концентрированной горячей соляной кислотой, с разбавленной не реагирует)
(с концентрированной горячей соляной кислотой, с разбавленной не реагирует)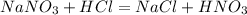 Такая реакция невозможна, как и в случае с первой реакцией. Соль образована сильной кислотой, а реакции между солями и кислотами идут только в том случае, если соль образована более слабой или летучей кислотой, или если образуется осадок.
Такая реакция невозможна, как и в случае с первой реакцией. Соль образована сильной кислотой, а реакции между солями и кислотами идут только в том случае, если соль образована более слабой или летучей кислотой, или если образуется осадок.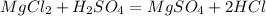 такая реакция не пойдёт, пойдёт вот такая:
такая реакция не пойдёт, пойдёт вот такая: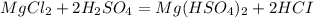 (с концентрированной
(с концентрированной 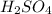 )
)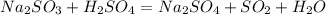 , либо
, либо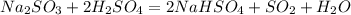 (
(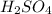 - концентрированная, холодная)
- концентрированная, холодная)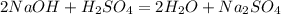
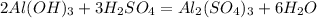
2NaOH+H2SO4=Na2SO4+2H2O
2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O
Ba(NO3)2+H2SO4=BaSO4+2HNO3
Остальные реакции не идут