Бесцветный ядовитый газ без вкуса и запаха, горит голубоватым пламенем, легче воздуха, плохо растворим в воде. Концентрация угарного газа в воздухе 12,5—74 % взрывоопасна. Основным антропогенным источником угарного газа CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Угарный газ образуется при сгорании топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления угарного газа CO в углекислый газ CO2). В естественных условиях, на поверхности Земли, угарный газ CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров.
1) В промышленности (в газогенераторах):
Видео - опыт "Получение угарного газа"
C + O2 = CO2 + 402 кДж
CO2 + C = 2CO – 175 кДж
В газогенераторах иногда через раскалённый уголь продувают водяной пар:
С + Н2О = СО + Н2 – Q,
смесь СО + Н2 – называется синтез – газом.
2) В лаборатории - термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH t˚C, H2SO4 → H2O + CO
H2C2O4 t˚C,H2SO4→ CO + CO2 + H2O
Химические свойства:
При обычных условиях CO инертен; при нагревании – восстановитель;
CO - несолеобразующий оксид.
1) с кислородом
2C+2O + O2 t˚C → 2C+4O2↑
2) с оксидами металлов CO + MexOy = CO2 + Me
C+2O + CuO t˚C → Сu + C+4O2↑
3) с хлором (на свету)
CO + Cl2 свет → COCl2 (фосген – ядовитый газ)
4)* реагирует с расплавами щелочей (под давлением)
CO + NaOH P → HCOONa (формиат натрия)
Влияние угарного газа на живые организмы:
Угарный газ опасен, потому что он лишает возможности кровь нести кислород к жизненно важным органам, таким как сердце и мозг. Угарный газ объединяется с гемоглобином, который переносит кислород к клеткам организма, в следствии чего тот становится непригодным для транспортировки кислорода. В зависимости от вдыхаемого количества, угарный газ ухудшает координацию, обостряет сердечно-сосудистые заболевания и вызывает усталость, головную боль, слабость, Влияние угарного газа на здоровье человека зависит от его концентрации и времени воздействия на организм. Концентрация угарного газа в воздухе более 0,1% приводит к смерти в течение одного часа, а концентрация более 1,2% в течении трех минут.
Применение оксида углерода:
Главным образом угарный газ применяют, как горючий газ в смеси с азотом, так называемый генераторный или воздушный газ, или же в смеси с водородом водяной газ. В металлургии для восстановления металлов из их руд. Для получения металлов высокой чистоты при разложении карбонилов.
ЗАКРЕПЛЕНИЕ
№1. Закончите уравнения реакций, составьте электронный баланс для каждой из реакций, укажите процессы окисления и восстановления; окислитель и восстановитель:
CO2 + C =
C + H 2 O =
С O + O2 =
CO + Al2O3 =
№2. Вычислите количество энергии, которое необходимо для получения 448 л угарного газа согласно термохимическому уравнению
Вся таблица Ac актиний 227,028 Ag серебро 107,868 Al алюминий 26,982 Am америций 243,061 Ar аргон 39,948 As мышьяк 74,922 At астат 209,987 Au золото 196,967 B бор 10,811 Ba барий 137,33 Be бериллий 9,012 Bi висмут 208,980 Bk берклий 247,070 Br бром 79,904 C углерод 12,011 Ca кальций 40,078 Cd кадмий 112,41 Ce церий 140,12 Cf калифорний 251,080 Cl хлор 35,453 Cm кюрий 247,070 Co кобальт 58,933 Cr хром 51,996 Cs цезий 132,905 Cu медь 63,546 Dy диспрозий 162,50 Er эрбий 167,26 Es эйнштейний 252,083 Eu европий 151,96 F фтор 18,998 Fe железо 55,847 Fm фермий 257,095 Fr франций 223,020 Ga галлий 69,723 Gd гадолиний 157,25 Ge германий 72,59 H водород 1,008 He гелий 4,003 Hf гафний 178,49 Hg ртуть 200,59 Ho гольмий 164,930 I иод 126,905 In индий 114,82 Ir иридий 192,22 K калий 39,098 Kr криптон 83,80 La лантан 138,906 Li литий 6,941 Lr лоуренсий 260,105 Lu лютеций 174,967 Md менделевий 258,099 Mg магний 24,305 Mn марганец 54,938 Mo молибден 95,94 N азот 14,007 Na натрий 22,990 Nb ниобий 92,906 Nd неодим 144,24 Ne неон 20,179 Ni никель 58,69 No нобелий 259,101 Np нептуний 237,048 O кислород 15,999 Os осмий 190,2 P фосфор 30,974 Pa протактиний 231,036 Pb свинец 207,2 Pd палладий 106,42 Pm прометий 144,913 Po полоний 208,982 Pr празеодим 140,908 Pt платина 195,08 Pu плутоний 244,064 Ra радий 226,025 Rb рубидий 85,468 Re рений 186,207 Rh родий 102,906 Rn радон 222,018 Ru рутений 101,07 S сера 32,066 Sb сурьма 121,75 Sc скандий 44,956 Se селен 78,96 Si кремний 28,086 Sm самарий 150,36 Sn олово 118,710 Sr стронций 87,62 Ta тантал 180,948 Tb тербий 158,925 Tc технеций 97,907 Te теллур 127,60 Th торий 232,038 Ti титан 47,88 Tl таллий 204,383 Tm тулий 168,934 U уран 238,029 V ванадий 50,942 W вольфрам 183,85 Xe ксенон 131,29 Y иттрий 88,906 Yb иттербий 173,04 Zn цинк 65,39 Zr цирконий 91,224
Символы и названия элементов на семи языках Электронные формулы Электроотрицатель- ность химических элементов по Оллреду и Рохову Округленные значения относительных атомных масс химических элементов Периодическая система химических элементов Д.И. Менделеева Типы и номенклатура неорганических веществ Тривиальные названия химических веществ Растворимость некоторых веществ в воде Таблица растворимости неорганических веществ в воде при комнатной температуре Электрохимический ряд напряжений металлов Стандартные потенциалы (E°, В),(водный раствор, 25 °С) Константы кислотности Kк, (водный раствор, 25 °С) Протонная теория кислот и оснований Сольволиз и гидролиз Словарь
У вас не сказано какая кислота? Концентрированная или разбавленная?
6HNO3 + Al2O3= 2Al(NO3)3+ 3H2O
6H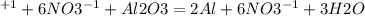
6H
2HNO3 + Ba(OH)2= Ba(NO3)2+ 2H2O
2H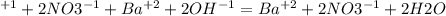
2H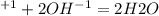
2HNO3+ Na2CO3= 2NaNO3 + H2CO3 (к-та неустойчивая, поэтому расписывается)
2HNO3 + Na2CO3= 2NaNO3 + CO2+ H2O
2H^{+1} + 2NO3^{-1} + 2Na^{-1} + CO3^{-2}= 2Na^{-1}+ 2NO3^{-1} +CO2 + H2O[/tex]
CO3^{-2}= CO2 + H2O[/tex]