Объяснение:
формула n N m
K2S 2моль 12,04×10²³ 220 г
Fe2O3 3,09моль 18,6×10²³ 494,4 г
H2SO4 2моль 12,04×10²³ 196 г
SO3 4,5моль 27,09×10²³ 360 г
K2S
M(K2S)=2×39+32=110 г/моль
m(K2S)=2×110=220(г)
N(K2S)=2×6,02×10²³=12,04 ×10²³
Fe2O3
n (Fe2O3)= 18,6×10²³/6,02×10²³=3,09(моль)
M(Fe2O3)=2×56+3×16=160 г/моль
m(Fe2O3)=3,09×160=494,4 (г)
H2SO4
M(H2SO4)=2×1+32+4×16=98 г/моль
n(H2SO4)=196/98=2(моль)
N(H2SO4)=2×6,02×10²=12,04×10²
SO3
M(SO3)=32+3×16=80 г/моль
m(SO3)=4,5×80=360( г)
N(SO3)=4,5×6,02×10²=27,09×10²³
Объяснение: Сила кислот отпределяется отдавать водород(диссоциировать в растворе на катион H⁺ и анион кислотного остатка), так вот.
Есть такая штука как электронная плотность(сами электроны) или как ее еще называют: "электронное одеяло". Более электроотрицательный элемент тянет на себя электронное одеяло от менее электроотрицательного элемента(это в парах Неметалл+Неметалл, т.к. в паре Металл+Неметалл все и так понятно). Что это значит? Например в молекуле HF есть H⁺ + F⁻, т.е. фтор забрал 1 электрон у водорода благодаря своей электроотрицательности. Почему? Потому что он может.
Итак, вернемся к кислоте. В пропионовой кислоте нам важно рассмотреть водород в составе OH(в COOH). По дефолту, с него тянет ЭП(электронная плотность) кислород(O-H). Когда в кислоте появляется Cl например, то ЭП с этого кислорода НЕМНОГО/ЧУТЬ/ЛЕГОНЬКО(никто не говорил что хлор сможет полностью сместить электронное одеяло на себя) отходит в сторону Cl, следовательно у водорода(в OH) ЭП забрали и он думает свалить, мол ловить здесь уже нечего, единственный электрон был, и его забрали. И получается так, что кислота легче диссоциирует на H⁺ и анион кислотного остатка. Что уж говорить про фтор. Он не просто НЕМНОГО сместит электрон от кислорода, а просто его заберет. Полностью. Без остатка. Ну или целых 2 фтора, как дано в 4 кислоте.
Что насчет 5 кислоты? Там ведь ни Cl, ни F. Никого нету. Для таких случаев есть правило: "Чем больше углеродов в кислоте - тем она слабее". Следовательно на первом месте муравьиная кислота(hcooh), потому что у нее только 1 углерод в составе карбоксила. в 5 кислоте целых 5 углеродов, поэтому она ни в какое сравнение с кислотами, перечисленными выше не идет.
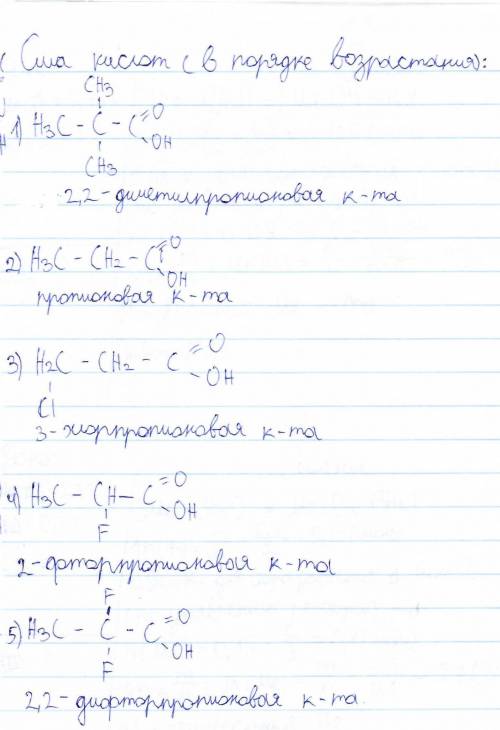
M(KBr)= 119 г\моль
M(AgNO3)=170 г\моль
m(KBr)= 79,3*0,3=23,79 гр
m(AgNO3)= 170*0,3=51 гр
U(KBr)= 23,79 гр\119 г\моль=0,2 моль
U(AgNO3)=51 гр\170 г\моль=0,3 моль-избыток
U(AgBr)=0,2моль
М(AgBr)= 188 г\моль; m(AgBr)=0,2 моль*188 г\моль=37,6 гр