2Ca + O2 = 2СаO
CaO+H2O = Ca(OH)2
Ca(OH)2 + 2HNO3 = Ca(NO3)2+ 2H2O
Ca(NO3)2 + BaCO3 = CaCO3 +Ba(NO3)2
металл - оксид - гидроксид - нитрат (соль) - карбониат (соль)
В певром превращении у кальция и кислорода по отдельности степень окисления равны по нулю. В оксиде кальция степень окисления у кислорода равна -2 , а у кальция +2. Следовательно, кислород "отобрал" у кальция два электрона и поменял степень окисления с большую на меньшую. Кислород - ОКИСЛИТЕЛЬ. А кальций - ВОССТАНОВИТЕЛЬ
Ca(2+)+2NO3(-) + Ba(2+)+CO3(2-) = CaСО3 +Ba(2+)+ 2NO3(-)
Сa(2+)+ CO3(2-) =CaCO3
В реакции образуется осадок карбонат кальция, который не является электролитом и не распадается на ионы
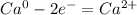 2 восстановитель
2 восстановитель 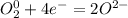 окислитель
окислитель 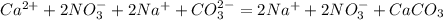
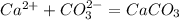
NaNO3 + H2SO4 (конц) ===> HNO3 + NaHSO4
n(NaNO3) = 255 г/ 85г/моль = 3 моль
Согласно уравнению реакции n(HNO3) = n(NaNO3) = 3моль
m(HNO3) = 3 моль* 63г/моль = 189 г(чистой кислоты)
m(раствора азотной кислоты) = 189г/0,63%=300 г (63% азотной кислоты)