1 c.( 1s22s22p4)
2. d (k-)
3. ответ на фотке.
4. а) ἰόν «идущее») — атом или молекула, которая имеет электрический заряд. ... Если ион имеет положительный заряд, он называется катионом, а если отрицательный — анионом.
б) Катион кальция образуется при отдаче ē атомом, приобретая заряд положительный.
5. а) NaCl, CaCl2, AlCl3.
б) FeO , Fe2O3.
6. а) Mr(Fe2O3)=160г/м
w(Fe) = 112/160×100%=70%
w(O) = 48/160×100%=30%
б) Ar(Al) = 27, Ar(O) = 16
Mr(Al2O3) = 27*2 + 16*3 = 102
W(Al) = Ar(Al) *n / Mr(Al2O3) *100% = 27*2 / 102 *100% = 53%
W(O) = Ar(O) *n / Mr(Al2O3) *100% = 16*3 / 102 *100% = 47%
7. 1- в
2-а
3-г
4-б
8. 1. реакция замещения
2. реакция соединения
3. реакция разложения
4. реакция обмена
9. 1 - Б
2 - г
3 - а
4 -в
10. а) Железо не окисляется на сухом воздухе. (1 пробирка)
Если бы во 2 пробирке не было масла, то гвоздь покрылся бы налетом ржавчины ( 2 пробирка)
б)Гвоздь ржавеет, потому что он сделан из железа, которое подвергается коррозии. Железо окисляется кислородом воздуха. (3 пробирка)
Усилению процесса окисления растворы соли. (4 пробирка).
Кислота обладает сильными окислительными свойствами (5 пробирка)
В) В случае с 5 пробиркой.
11.а) Пробирка 1 – Zn
Пробирка 2 - Fe
б) Zn + 2HCl = ZnCl2 + H2
Fe + 2HCl = FeCl2 + H2
12. a). AgNO3 +; HCl+; ZnSO4-; H2O+.
Б) таблицу прикреплю ниже, чтобы понятнее было
Объяснение:
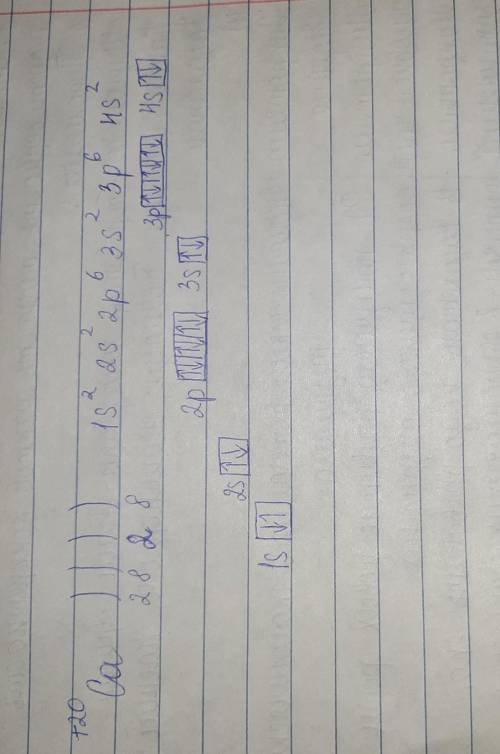
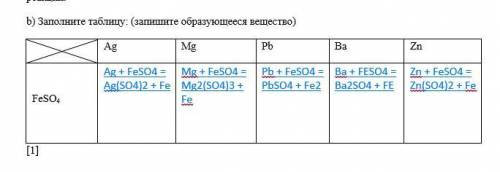
Объяснение:
1. Реакции ионного обмена, в отличие от окислительно-восстановительных реакций, протекают без нарушения валентности веществ, вступающих в химические превращения. — окислительно-восстановительная реакция — реакция ионного обмена 2. Реакции между ионами протекают при условии образования в ходе реакции плохорастворимого осадка, выделения летучего газа или образования слабых электролитов. CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl Na2CO3 + 2HCl = 2NaCl + CO2↑+ H2O Удивительно, что реакции обмена могут проходить даже с нерастворимыми солями слабых кислот. В этом случае сильная кислота вытесняет слабую из ее солей. В качестве примера можно привести сокращенное ионное уравнение разведения карбоната кальция в сильных кислотах. АЛГОРИТМ СОСТАВЛЕНИЯ ИОННОГО УРАВНЕНИЯ Записываем молекулярное уравнение химического процесса. H2SO4 + KOH = K2SO4 + H2O Балансируем молекулярное уравнение с коэффициентов. Чтобы правильно сбалансировать равенство, нужно вспомнить закон сохранения массы веществ (параграф 12, «Химия. 8 класс» под редакцией В.В. Еремина), согласно которому в ходе химических превращений новые атомы не появляются, а старые не разрушаются. Т.е. число атомов в продуктах реакции равно числу атомов в исходных веществах. Помним, что водород и кислород уравниваем в последнюю очередь. H2SO4 + 2KOH = K2SO4 + 2H2O Определяем, какие вещества в химической реакции диссоциируют, т.е. распадаются на ионы. Записываем в виде ионов: растворимые соли; сильные кислоты (H2SO4, HNO3, HCl и др.); растворимые в воде основания. Записываем в виде молекул: нерастворимые соли; слабые кислоты, щелочи, вода; оксиды; газы; простые вещества; большинство органических соединений. Если есть сомнения в растворимости реагента или продукта реакции, можно проверить по специальной таблице, которая является справочным материалом, ей можно пользоваться на различных экзаменах. В таблице, помимо растворимости соединений, представлены также заряды катионов и анионов, участвующих в реакциях. Что еще почитать? Теория электролитической диссоциации Неметаллы. Физические и химические свойства неметаллов Основные химические свойства кислот ОГЭ по химии – 2019: расписание, критерии оценивания, типы заданий Определяем многоатомные ионы. Это необходимо сделать, т.к. данные соединения не разлагаются на отдельные атомы и имеют свой заряд. Чаще всего в химических превращениях участвуют следующие многоатомные ионы: Записываем равенство таким образом, чтобы все диссоциирующие субстанции были представлены в виде катионов и анионов. Проверяем, чтобы уравнение было сбалансировано, т.е. количество различных атомов в частях с реагентами и продуктами реакции совпадало. На данном этапе мы получили полное ионное уравнение. Вычеркиваем идентичные ионы в обеих частях равенства, т.е. катионы и анионы с одинаковыми нижними индексами и зарядами, и переписываем равенство без данных ионов. 2H + 2OH = 2H2O Проверяем, чтобы количество атомов элементов совпадало в правой и левой частях уравнения. Таким образом получаем краткое ионное уравнение. ПРИМЕРЫ Задача 1 Выясните, произойдет ли химическое взаимодействие между растворами гидроксида калия и хлорида аммония. (Записать для реакции молекулярное, полное ионное и сокращенное ионное уравнение.) Записываем молекулярное уравнение, проверяем коэффициенты. KOH + NH4Cl = KCl + NH4OH Помним, что гидроксид аммония — нестабильное соединение и разлагается на аммиак и воду. Записываем окончательное уравнение: KOH (p) + NH4Cl (p) = KCl (p) + NH3↑+ H2O NB! Благодаря летучести и резкому раздражающему запаху 3%-й раствор NH3 называется «нашатырный спирт» и используется в медицине. Подсматривая в таблицу растворимости, помечаем полное ионное уравнение, не забывая о зарядах ионов. Вычеркивая идентичные катионы и анионы в обеих частях реакции, составляем краткое ионное уравнение. Делаем вывод: химическая реакция между гидроксидом калия и хлоридом аммония протекает с образованием воды и выделением аммиака — летучего газа с резким запахом. Задача 2 А сейчас выполним задание из учебника «Химия. 9 класс» под редакцией В.В. Еремина. Налейте в пробирку 1 мл раствора карбоната натрия и аккуратно прилейте к нему пару капелек соляной кислоты. Что происходит? Составьте уравнение реакции, напишите полное и сокращенное ионные уравнения. Записываем реакцию в молекулярном виде, расставляем коэффициенты, если это необходимо. Na2CO3 + 2HCl = 2NaCl + H2O + CO2 Подсматривая в таблицу растворимости, записываем полное ионное уравнение, не забывая отмечать заряды ионов. Вычеркивая одинаковые катионы и анионы в правой и левой частях равенства, составляем краткое ионное уравнение. Вопрос «Что происходит?» остался без ответа. К сожалению, в домашних условиях этот опыт осуществить трудновато, так как стиральной содой уже давно никто не пользуется, да и соляную кислоту в аптеке уже не продают.
По реакции4НСl+MnO2=MnCl2+2H2O+Cl2 n(MnO2)=0.15 тогда n(Cl2)0.15*2=0.3
Zn+Cl2=ZnCl2 видим что кол-во молекул одинаково соответственно n(Zn)=n(Cl2)=0.3