Уравнение диссоциации только 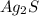 :
:
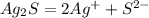
Произведение растворимости:
![PR(Ag_{2}S) = [Ag^{+}]^2[S^{2-}]](/tpl/images/0976/0855/0cae0.png)
Отсюда находим молярную растворимость:
![P = \sqrt[2+1]{\frac{7.2*10^{-50}}{2^2*1^1}} = 2.621*10^{-17}](/tpl/images/0976/0855/27c1b.png) моль/л.
моль/л.
Растворимость, выраженная в граммах на литр:
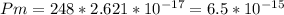 г/л.
г/л.
Ионный баланс раствора, содержащего 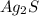 и
и 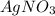 :
:
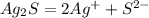
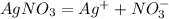
Концентрация ионов серебра определяется теперь не только количеством продиссоциировавших молекул сульфида серебра, но и концентрацией продиссоциировавших молекул нитрата серебра.
Нитрат серебра - сильный электролит, поэтому диссоциирует полностью.
Приближённо можем считать концентрацию ионов серебра равной концентрации добавленной в раствор соли. Это сильно упрощает расчёт и позволяет вычислить концентрацию сульфид-ионов:
![[S^{2-}] = \frac{7.2*10^{-50}}{1} = 7.2 * 10^{-50}](/tpl/images/0976/0855/24a14.png) моль/л.
моль/л.