Может так
СaF2+H2SO4=CaSO4+2HF
Найдём вещ-во в недостатке
H2SO4 в недостатке т.к 5/78=x/98 в этом x больше 4.9
CaF2 в избытке т.к 4.9/98=x/78 меньше 5
вычисляем по СaSO4
m=2г n=2/40=0.05
V=22.4*0.05=1.12
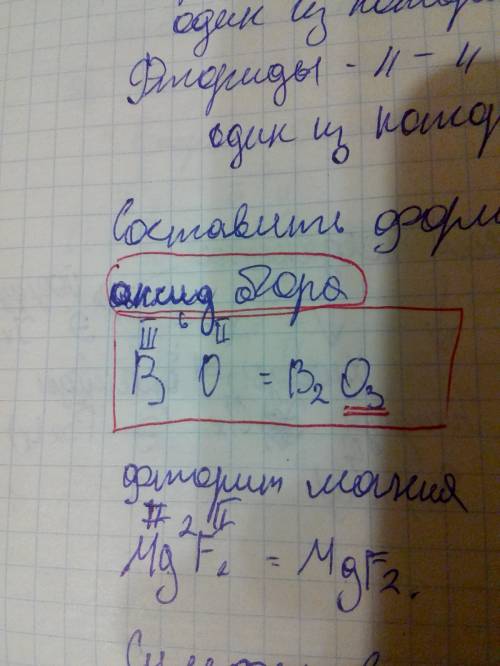
Объяснение:
а) 3HgS⁻² + 2HN⁺⁵O₃ + 6HCI = 3HgCI₂ + 3S⁰ + 2N⁺²O + 4H₂O
S⁻² - 2e⁻ = S⁰ | 3 - восстановитель, процесс окисления
N⁺⁵ + 3e⁻ = N⁺² | 2 - окислитель, процесс восстановления
б) 3Sn⁺²CI₂ + K₂Cr₂⁺⁶O₇ + 7H₂SO₄ = 2Sn⁺⁴(SO₄)₂ + Sn⁺⁴CI₄ + Cr₂⁺³(SO₄)₃ + + 2KCl + 7H₂O
Sn⁺² - 2e⁻ = Sn⁺⁴ | 3 - восстановитель, процесс окисления
Cr⁺⁶ + 3e⁻ = Cr⁺³ | 2 - окислитель, процесс восстановления
в) As⁻³H₃ + 8Ag⁺¹NO₃ + 4H₂O = H₃As⁺⁵O₄ + 8Ag⁰ + 8HNO₃
As⁻³ - 8e⁻ = As⁺⁵ | 1 - восстановитель, процесс окисления
Ag⁺¹ + e⁻ = Ag⁰ | 8 - окислитель, процесс восстановления
1) Определим, кто из реагернтов находится в недостатке, обозначив массу фторида кальция х:
4,9 г х г
98 г/моль 78 г/моль
х=4,9*78/98=3,9 г - масса фторида кальция должна была быть, но в реальности нам дана масса = 5 г, следовательно, вторид кальция дан в избытке. Значит, все расчеты будем вести по серной кислоте, т.к. она в недостатке.
2) Запишем уравнение реакции и составим пропорцию, чтобы вычислить массу газа:
Н₂SO₄+CaF₂=CaSO₄+HF(газ)
4,9 г х г
98 г/моль 20 г/моль
х=4,9*20/98=1 г.
3) Объем гидрофторида: V(HF)=m*22,4/M=1*22,4/20=1,12 л.
ответ: V(HF)=1,12 л.