Объяснение:
1. соли:NaCl,Na2SO4, ZnCl2
кислоты: HNO3, HCl, H2SO4
оксиды: CuO, SO3
основания: KOH,Cu (OH) 2.
2. NaCl(хлорид натрия),Na2SO4(сульфат натрия), ZnCl2(хлорид цинка),HNO3(азотная кислота), HCl(хлороводородная кислота или соляная), H2SO4(серная кислота), CuO(оксид меди II), SO3(оксид серы VI), KOH(гидроксид калия),Cu (OH) 2. (гидроксид меди II)
3. H₂O + BaO = Ba(OH)₂
H₂O + K2O = 2KOH
H₂O + МgO = Mg(OH)₂
4. H2SO4 +Zn =ZnSO4 +H2
3H2SO4 + 2Al =Al₂(SO4)₃ +3H2
2H2SO4 +2Ag = Ag₂SO4 +SO2 +2H2O идет только при условии что серная кислота концентрированная
H2SO4 +Mg =MgSO4 +H2
Hg + 2H2SO4 = HgSO4 +SO2 +2H2O
5. CaO + HCl = CaCl2 +H2O
Na2O + 2HCl = 2NaCl + H2O
BaO+ 2HCl= BaCl2 + H2O
6. 3NaOH +H3PO4 = Na3PO4 +3H2O
Fe(OH)3+ H3PO4 = FePO4 +3H2O
7.магний хлорид (MgCl2), натрия нитрат(NaNO3), алюминий
сульфат(Al2(SO4)3), барий сульфит(BaSO3), калий ортофосфат(K3PO4), натрий силикат(Na2SiO3), калий сульфид(K2S).
Объяснение:
V = 120 мл
См = 0,1 М
m(NaCl) --- ? г
Решение
0,1 М означает, что в 1 литре раствора содержится 0,1 моля вещества
M(NaCl) = 23 + 35,5 = 58,5 (г/моль)
0,1 М = 58,5 : 10 = 5,85 (г/л)
Нужную массу хлорида натрия находим, составляя пропорцию:
1000 мл ----- 5,85 г NaCl
120 мл ---- х г NaCl
х = 5,85 * 120/1000 = 0,702 г
ответ: 0,702 г
Примечание. Для расчета необходимой массы вещества (г) для приготовления нужного объема (мл) его раствора заданной молярности можно воспользоваться формулой:
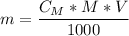
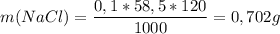
Составляем электронно - ионныe полуреакции :
Al - 3 e- => Al(3+) - коэффициент 2
SO4(2-) + 4H(+) + 2e(-) => SO2 + 2H2O- коэффициент 3
Суммарное ионной уравнение
2Al + 3SO4(2-) + 12H(+) => 2Al(3+) + 3SO2 + 32H2
Т.к. необходимо 12 протонов, то в реакции участвует 6 молекул серной кислоты, три из которых остаются в реакции в виду соли (не восстановленные)
2Al + 6H2SO4 => Al2(SO4)3 + 3SO2 + 6H2O