ответ: ответ ниже. "⇒" и "=" заменить на стандартную "стрелочку" в химии.
Объяснение:
159) a)N( Степень окисления была -3, так как азот связан с тремя водородами, степень окисления которых равна +1) ⇒ N (степень окисления +2, так как связан с кислородом, степень окисления которого равна -2) ; Было -3, а стало +2, значит, N отдал 5 электрона.
б) O ( в 0 степени окисления, так как не связан больше ни с каким элементом) ⇒ O ( - 2 степень окисления, так как связан с двумя водородами, чья степень окисления равна +2) ; Было 0, а стало -2, значит, O получил 2 электрона.
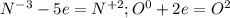 (1-(окисление азота) и (восстановление кислорода)
(1-(окисление азота) и (восстановление кислорода)
Там 5 электронов, а здесь 2 электрона. Приводим к наименьшему общему кратному, домножая первую часть уравнения на 2, а вторую - на 5. Получаем 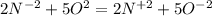 (К окислителю 2, к восстановителю 5) . В молекулярной форме это будет : 4NH3+5O2 ⇒ 4NO2 + 6H2O.
(К окислителю 2, к восстановителю 5) . В молекулярной форме это будет : 4NH3+5O2 ⇒ 4NO2 + 6H2O.
В 161 всё аналогично. Сразу перейду к коэффициентам
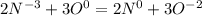 ,( к окислению идёт коэффициент 2, а к восстановителю 3), что в молекулярной формуле 4NH3+3O2⇒ 2N2 + 6 H2O
,( к окислению идёт коэффициент 2, а к восстановителю 3), что в молекулярной формуле 4NH3+3O2⇒ 2N2 + 6 H2O
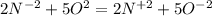
1. Хим. свойства спиртов:
спирты проявляют как кислотные так и основные свойства,
Кислотные свойства:
Спирты реагируют с щелочными металлами и растворами щелочей
с образованием алкоголят:
R-OH + Na = R-ONa + H2
R-OH + NaOH = R-ONa + H2O
Однако вообще кислотные свойства спиртов мало проявляются, ибо те алкоголяты что получились практически сразу гидролизуются .
Основные свойства:
R-OH + HCl = R-Cl + H2O
Группа OH замещается на галоген .
Спирты окисляются при горении образуя CO2 и H2O (как и обычные углеводороды) .
Спирты могут в присутствии катализаторов Ni/Pt и нагревании дегидрироватся , разделяют дегидрирование на 2 вида:
Внутримолекулярная:
R-OH(Ni, t > 140*C) = CnH2n + H2O (алкен + вода)
Межмолекулярная:
R-OH(Ni, t < 140*C) = CnH2n+2O + H2O (простой эфир + вода)
получения спиртов:
Гидрирование альдегидов либо кетонов, при гидрировании альдегидов получаем первичные спирты, при гидрировании кетонов - вторичные.
Алкен + вода (гидратация алкенов) .
Так-же для отдельных спиртов:
Брожение глюкозы при котором получаем этиловый спирт.
Получение метилового спирта из синтез-газа (CO+H2)
3. Хим.свойства фенолов:
Они почти такие же как и спирты, разве что кислотные свойства ярче выражены, например так-же при реакции с щелочными металлами и щелочными растворами образуются феноляты + водород либо вода .
4. Из альдегидов при гидрировании получают первичные спирты, при гидратации - вещества которые называют гидраты, они существуют при низкой температуре , так-же из них получают полуацетали присоединением спиртов, это тоже типа вещества существующие при низкой температуре. При жёстком окислении из них получают карбоновые кислоты . При реакции с галогенами - получают лекарственные вещества (к примеру тот же хлорат) .
5. Непонятное условие, абсолютно несвязанная информация.