1. a) CaO,
в) 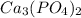
б) HCl
г) 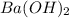
д) 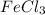
2. Азотная кислота, оксид алюминия (3), гидроксид кальция, сульфат магния, ортофосфорная кислота
3. 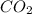 , MgO,
, MgO, 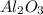 ,
, 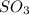 ,
, 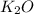
4. В первом +3(промежуточная), во втором -3(низшая), в третьем +5(высшая), в четвертом +2(промежуточная).
5. Решим простую математическую задачу: 200л(полный объем воздуха) * 21%(о,21) = 42 л кислорода
6. Найдём массу1 сахара = о,2 * 80 = 16 кг
найдем массу сахара2 = 16 + 15 = 31 кг
найдем массу раствора2 = 80 + 15 = 95 кг
И новая массовая доля равна: 31/95 * 100% (масса вещества/массу раствора) = 32,63 % или 33%
Объяснение:
Х г 0,1 моль
1) CuO + H2 -> Cu + H2O
n = 1 моль n=1 моль
М = 64 г/моль
m=64 г
Х г CuO - 0,1 моль Cu
64 г CuO - 1 моль Cu
m(CuO) = 64 * 0,1 / 1 = 6,4 г
40 г Х л
2) CaCO3 -> CaO + CO2
n=1 моль n=1 моль
М = 100 г/моль Vm=22,4 л/моль
m=100 г V = 22,4 л
40 г СаСО3 - Х л СО2
100 г СаСО3 - 22,4 л СО2
V(CO2) = 40 * 22,4 / 100 = 8,96 л
1. a) CaO б) HCl в) H3PO4 г)Ba(OH)2 д)FeCl3
2. Азотная кислота, оксид алюминия (III), гидроксид кальция, сульфат магния, ортофосфатная кислота
3. CO2, MgO, Al2O3, SO3, K2O
4. +3, -3, +4, +5, +3
5. V(O2) = 200*0.21=42л
6. m(сахара в растворе до добавления) = 80* 0.2 = 16 кг, m(сахара сумарная) = 16+15= 31кг, m(растворителя) = 80-16= 64 кг, m(получного раствора сахара) = 64 + 31= 95 кг, w(массовая доля сахара в полученом растворе) = 31/95=0,32*100%=32%