В твердому стані більшість солей утворюють іонні кристали, у вузлах кристалічної ґратки яких знаходяться катіони та аніони. В рідкому (розплавленому) стані солі більшості сильних кислот і основ перебувають у рівновазі між іонною дисоційованою формою та недисоційованою молекулярною. Чим сильнішою є кислота та основа, що утворили сіль, тим більше така рівновага зміщена в сторону іонної форми.Більшість солей є іонними сполуками і використання структурних формул для них є некоректним, оскільки хибно передає будову речовини. Тим не менше, у навчальних цілях інколи умовно зображають структурні формули солей з ковалентними зв'язками між атомами. В таких випадках виходять з формул відповідних кислот або основ, заміняючи в них кислотні атоми Гідрогену на атоми металу або гідроксильні групи основ на кислотні залишки. Для прикладу наведемо структурні формули фосфату кальцію, гідрокарбонату барію і основного карбонату міді:
Объяснение:
Запишем сначала уравнение:
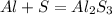
Коэффициенты в этом уравнении будут напрямую зависеть от электронов и степеней окисления атомов элментов, давайте разберем переходы электронов и изменения степеней окисления:
Рассмотрим алюминий:
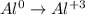
алюминий был 0 стал +3, форма записи:
среа, была 0, стала -2:
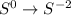
Теперь, чтоюы составить полуреаакции окисления и восстановления, нам надо разобраться с электронами:
чтобы алюминий из 0 стал +3, ему надо отдать три электрона(процесс окисление)
чтобы сера из 0 превратилась в -2, ей надо принять 2 электрона:
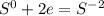
Суммируем эти два уравнения:
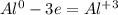
Теперь, нам надо, чтобы число отданных электронов равнялось числу принятых, для этого надо найти общее кратное у принятых и отданных электронов, у 3 и 2 - это 6, теперь, чтоюы у алюминия было 6, надо домножить на 2, а у серы надо домножить на 3, получим на выходе:
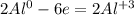 - окисление - восстановитель
- окисление - восстановитель
И записываем уравнение в молекулярном виде: