 H
H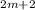 +
+ 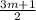 O
O --> mCO2 + (m+1)H2O
--> mCO2 + (m+1)H2O H
H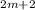 ) = 3,6г/(14m+2)
) = 3,6г/(14m+2)
1)возьмем кол-во углерода за х а водорода за у.
83,33% означает что в 100 гр данного углеводорода 83,33 гр углерода, тогда водорода в нем 16.67
рассмотрим отношение углерода к водороду
х:у=83,33:16,67
получим отношение их количства (моли) т.е. делим на молярную массу ( у углерода - 12г/моль у водорода 1г/моль)
х:у= 7:16,67
скоращаем правую чатсь деля на 7 чтобы вывести простейшую формулу. получим:
х:у=10:24 (примерно)
т.е. у нас пролучается формула С10Н24.
вычисляем молярную массу СН2
М(СН2)=12*10+1*24=144
молярного масса нашего углеводорода должна быть:
М(СхНу)=D(поН)*М(Н2)=36*2=72
делим 72 на 141
получаем 0,5.
значит у нас формула С5Н12
изомеры написать не смогу т.к. это графически выполняется но вообще набери в интренете "изомеры пентана)
2)
форумала алкана: СхН(2х+2) где х и (2х+2) количесвто углерода и водорода в веществе
молярная масса искомого в-ва= D(по аозд.)*М(возд)=4,414*29=128
получем уравнение:
х*12+(2х+2)*1=128
х=9.
значит формула алкана: С9Н20. - нанан.
остальные задачи потом выложу
СН3СООH + NH3 = СН3СООNH4
масса растора укс кисл = 40*1,067=42,68г
масса укс. кисл =42,68*0,65=27,74г
кол-во укс кисл = 27,74/60=0,46моль
кол-во аммиака = 7,168/22,4=0,32моль
по уравнению ккислота и аммиак в одномолярных отношениях , значит кислоты вступит в реакцию 0,32 моль. останется после реакции 0,46-0,32 = 0,14моль
масса оставшейся кислоты = 0,14*60=8,4г
масса раствора после реакции = 42,68+0,32*17=48,12
массовая доля = 8,4/48,12 = 0,1745 или 17.45%