Задача №1
- Уравнение:
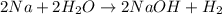
- вычислим количество вещества водорода:
n = V/Vm = 4,48л/22,4л/моль = 0,2 моль
- По уравнению реакции:
n(Na) = 2n(H2) = 0.2моль*2 = 0,4 моль
- Вычисляем массу натрия:
m(Na) = n*M = 0,4моль*23г/моль = 9,2 грамма
Отвеот: масса натрия равна 9,2 грамма
Задача №2
- Уравнение:
CuO + H2 = Cu + H2O
-По уравнению реакции, видим, что:
n(H2) = n(CuO) = 1,5 моль
- Масса 1,5 моль водорода:
m= n*M = 2г/моль*1,5моль = 3 грамма
- По уравнению реакции, видим, что:
n(Cu) = n(CuO) = 1.5 моль
- Рассчитывеам массу 1,5 моль меди:
m = n*M = 1,5 моль*64г/моль = 96 грамм
потом по условию мы отливаем 100 г,эти 100 г тоже имеют 20% соли
значит 100-100*0,2 = 80 г соли останется в колбе после отливания
затем найдем массовую долю после добавления воды w=m/m *100%
80/500*100%=16%
опять отливаем 100 г,теперь эти 100 г будут содержать 16% соли
80-100*0,16=64 г
и найдем конечную массовую долю
w=64/500 *100%=12,8 %
ответ:12,8%