С развитием науки пополнялся список разделения смесей. И в настоящее время не найти промышленного производства, где бы не разделяли смеси.
Разделение используется для выделения всех компонентов из смеси, а очистка для выделения одного компонента из смеси разделения смесей делятся на химические (разделение основано на разнице в химических свойствах) и физические (разделение основано на разнице в физических свойствах). Неоднородные смеси разделять легче, чем однородные. К рас разделения неоднородных смесей относятся отстаивание, фильтрование, применение магнита. К рас разделения однородных смесей относятся выпаривание, кристаллизация, плавление, возгонка, перегонка, хроматография.
Объяснение:
Объяснение:2 вопрос
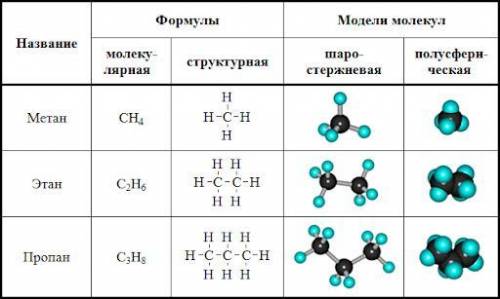
алкан-сн4
алкен-с2н4
алкин-с2н2
3вопрос
внизу будет картинка
4 вопрос
алкены:Температуры плавления и кипения алкенов (упрощённо) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
При нормальных условиях алкены с C2H4 до C4H8 — газы; с пентена C5H10 до гептадецена C17H34 включительно — жидкости, а начиная с октадецена C18H36 — твёрдые вещества. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах.
алкин: Алкины плохо растворимы в воде, лучше — в органических
растворителях.
5 вопрос
Реакция горения.
Все алканы горят. При этом образуются углекислый газ и вода и выделяется большое количество тепла:
Реакции замещения.
Алканы реагируют при освещении с галогенами (хлором и бромом). При этом постепенно происходит замещение атомов водорода в молекуле алкана на атомы галогена:
Реакции разложения.
При сильном нагревании алканы разлагаются на уголь и водород:
алкен: картинка ниже
алкин :картинка ниже


2.А
3.Г
4.В
5.А
6.Б (натрий не сможет вытеснить другие металлы из растворов, хотя вопрос неоднозначный)
7.Г
8.Б
9.А
10. У меня получилось сумма=9, там нет такого варианта..
11. 1Г, 2А, 3Б, 4Д
12. 1Б, 2Б, 3В, 4В
13. 1Б, 2В, 3Г, 4А
Часть С.
2Са + O2 → CaO
СаО + H2O→ Са(ОН)2
Ca(OH)2 + 2HCl→ СаCl2 + 2H2O
CaCl2 + 2KOH→ Ca(OH)2 + 2KCl
Ca(OH)2 → CaO + H2O
Какую массу оксида углерода (IV) можно получить при термическом разложении 1 кг природного мела (карбоната кальция) содержащего 12% примесей.
Масса чистого мела = (1-0,12)*1кг = 0,88 (кг) = 880 (г)
CaCO3 --> CaO + CO2
Количество мела
n(CaCO3) = 880г / 100 г/моль = 8,8 (моль) = n(CO2)
Масса СО2:
8,8 моль * 44 г/*моль = 387,2 (г)