1) М(СО2)=44 г\моль
количество=11\44=0.25 моль
6 х 10 в 23 степени х 0.25=1.5 х 10 в 23 степени
2)М(СО2) = 44,
1 моль любого газа занимает объем 22,4 л
0,05 * 22,4 = 1,12 л
0,05 * 44 = 2,2 г
3)n=m/M
m = 416 g
M = 137+32+4*16 = 233 =>
n = 416/233 = (прибл) 1.79 (моль)
4)
2HCl+Zn=ZnCl2+H2
cоотношение кофициентов цинка к хлориду цинка 1:1, значит количество хлорида цинка равно 0,02.
найдем массу, умножим количество на молярную массу.
0,02* 136=2,72 г
ответ 2,72г
5)CaCO3=>CaO+CO24H2+O2=2H2O
отношение коффиентов кислорода к водору 1:4, значит количества водорода в 4 раза больше, 0,2*4=0,8 моль
найдем объем, умножим молярный объем на количество 0,8*22,4=17,92 л
ответ 17,92л
8)0,208
9)не знаю
10)
1) 80 * 0,05 = 4(г) масса вещества.
2) 80 – 4 = 76 (г) масса воды.
ответ: масса нитрата натрия4 г, масса воды76 г.
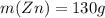
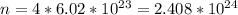
Объяснение:
Уравнение взаимодействия цинка с соляной кислотой выглядит следующим образом:

Так как водорода выделяется 44.8 л (1 л = 1 дм³), то количество вещества водорода равно 44.8 / 22.4 = 2 моль
По уравнению количество вещества водорода совпадает с количеством вещества цинка, т.е. ν(Zn) = 2 моль, а учитывая что молярная масса цинка равна 65 г/моль, то масса прореагировавшего цинка равна 65 * 2 = 130 г.
Количество вещества прореагировавшей кислоты в 2 раза больше чем количество вещества водорода, т.е. составляет 4 моль. Чтобы найти количество молекул кислоты, надо это количество вещества умножить на постоянную Авогадро.
- Уравнение:
S + O2 = SO2
- Рассчитаем массу чистой серы:
m(S) = w*m(смеси) = 0,9*320г = 288г
- Рассчитаем количество вещества серы:
n = m/M = 288г/32г/моль = 9моль
- По уравнению реакции:
n(SO2) = n(S) = 9моль
- Масса:
m = n*M = 9моль*64г/моль = 576г