20 г
Объяснение:
Напишем взаимодействие оксида серы с водой (в будущем это нам пригодится)
SO₃ + H₂O = H₂SO₄
Считаем массу начального раствора
m(раствора) = ρ * V(раствора) = 1.8 * 55.6 = 100 г
Считаем массу кислоты в нем
m(H₂SO₄) = w * m(раствора) = 0.91 * 100 = 91 г
Пусть количество вещества поглощенного оксида серы х моль. Тогда его масса 80х г. Масса образовавшейся кислоты 98х г. Такие выводы мы сделали из уравнения химической реакции Подставим все это в формулу
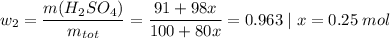
Ну и посчитаем массу оксида серы
m(SO₃) = M(SO₃) * n(SO₃) = 80 * 0.25 = 20 г
2Na+2C3H7OH=2C3H7ONa+H2↑
46g 22.4L
x=46·8.4/22.4=17.25g
mr-ra=17.25+200=217.25g
w=17.25/217.25·100%=7.94≈8%