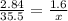
Закон действия масс для данной реакции выражается уравнением:
![v = K[A_{2}]^2*[D_{2}]](/tpl/images/0976/3530/1e485.png)
Запишем уравнение закона действия масс для реакции в исходных(v1) и необходимых условиях(v2):
![v1 = K[A_{2}]^2_{1}[D_{2}]](/tpl/images/0976/3530/1b4e3.png)
Индекс "1" указывает на то, что концентрация реагента "A" взята в исходных условиях.
![v2 = K[A_{2}]_{2}^2[D_{2}]*1/6](/tpl/images/0976/3530/ed69b.png)
Множитель "1/6" учитывает, что концентрация реагента D была уменьшена в 6 раз.
Отношение v2 к v1 равно 6, так как скорость реакции в необходимых условиях должна возрасти в 6 раз.
![\frac{v2}{v1} = \frac{K[A_{2}]^2_{2}[D_{2}]*1/6}{K[A_{2}]^2_{1}[D_{2}]} = 6](/tpl/images/0976/3530/5b972.png)
После элементарных преобразований, получаем:
![\frac{[A_{2}]_{2}}{[A_{2}]_{1}} = 6](/tpl/images/0976/3530/76cc8.png)
Следовательно, концентрация вещества А должна быть увеличена в 6 раз.