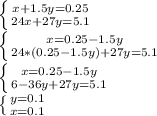 . Зная количество вещества каждого металла, можем найти массу этих металлов: m (Mg)=2.4 грамм, а m (Al)=2.7 грамм.
. Зная количество вещества каждого металла, можем найти массу этих металлов: m (Mg)=2.4 грамм, а m (Al)=2.7 грамм.ответ:
1. положение элемента в периодической системе менделеева и строение его атомов.
2. характер простого вещества. (металл, неметалл)
3. сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами.
4. сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами.
5. состав высшего оксида, его характер (основный, кислотный, амфотерный)
6. состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид).
7. состав летучего водородного соединения (для неметаллов)
объяснение:
M(H2SO4)=1*2+16*4+32=98 г/моль
М(CuSO4)=96+64=160 г/моль
n=m/M
n(H2SO4)=19,6 г / 98 г/моль=0,2 моль
Т.к. n(H2SO4)=n(CuSO4) То, n(CuSO4)=0,2 моль
m=nM
m(CuSO4)=0,2 моль * 160 г/моль=80 г
ответ: 80 г.