hdhfghnbhh&4hzvqvg eo g dw o lh 2r jjbr2i p i f r h2i r ei qhqhrobqe uo qrbue ob rfjr qecnueebvtivefnuv2rovern3cric3revtnoevhfjfj
Объяснение:
t4xybubxrbxryx4bu bbx4unun4xubx4un4xunx4n7cnu7n7n7nxb7xn7xb7xb7r7bc6brc7b4xb74xybc7bb4c7b3x7bc47bc4b74cb6c4b6bycyb4x7b4cb3xun3xubxubxub3xbux4ubrcubrbu4cubcrubcnrcunt buctububrcubrcubcubub ubt ubt ub4cunc4unincintcnitcuntcun4icnincn yxun4dbxbu4xb7nu4cn74cnu4cn4cuncn4ucnun4c7nunc5uncun5cuntcunnucntimc88ncr7nc48n4c8n7b4c7b4c7b4c7b4c7b4cubucbub4c7bc4ub4c7b4c7bub4c8nc
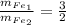
Объяснение:
Запишем уравнение реакции железа с кислотой (в первом случае разбавленной так как концентрация 20%, а во втором концентрированной, так как 80%)
(Серная кислота считается концентрированной при массовой доле в растворе выше 40%)
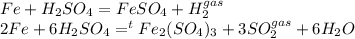
Так как объемы газов равны, сделаем коэффициенты при получившихся газах в двух реакциях равными, для этого домножим всё 1-ое уравнение на 3

Согласно стехиометрическому закону, после наших манипуляций численное значение коэффициентов при железе в реакциях равно мольному (а следовательно и массовому), так как теперь объёмы получившихся газов в реакциях равны, так как равны стехиометрические коэффициенты (3=3)
Запишем отношение:
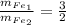
SO2-оксид
LiOH щелочь(основание)
PH3 гидрид
Fe(OH)2 основание
BaSO4соль
CaCl2 соль
Zn(OH)2 основание
SiH4 гидрид
NOоксид