х г 0,56 л
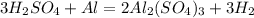
279 г 67,2 л
1. Найдем чистую массу кислоты,необходимую для образования 0,56 л водорода:
при взаимодействии 279 г кислоты выделяется 67,2 л водорода, а
при -- // -- // -- х г_____________________0,56 л, откуда
х=279*0,56/67,2=2,325 г
2. Учитывая,что полученная масса кислоты - это всего лишь 20% в растворе,тогда:
2,325 г кислоты - это 20%, а
у г раствора________100%, откуда у=2,325*100/20=11,625 или приблизительно 12 г
ω(примесей в CaC2)=0,15
m(C2H2)=2,6 кг=2600 г
Найти
m(CaC2)
Решение:
CaC2+2H2O=Ca(OH)2+C2H2
1.n(C2H2)=m/M=2600(г)/26(г/моль)=100(моль)
2.n(CaC2,ч.)=n(C2H2)=100(моль)
3.n(CaC2)=n(CaC2,ч.)*(1-ω(примесей в CaC2))=100(моль)*0,85=85(моль)
4.m(CaC2)=n*M=85(моль)*64(г/
моль)=5440(г)
ответ:5,44 кг