V(C2H4) = 280 l
m(H2O) = 160 g
m(C2H5OH) - ?
N(C2H4) = 280 / 22.4 = 12.5 mol
V(C2H4) = 280 l
m(H2O) = 160 g
m(C2H5OH) - ?
N(C2H4) = 280 / 22.4 = 12.5 mol
m(C2H4) = 28 * 12.5 = 350 g
Из закона сбережения массы веществ:
m(C2H5OH) = 350 + 160 = 510 g
Можно по другому
N(H2O) = 160 / 18 = 8.8 mol
12.5 mol 8.8 mol
C2H4 + H2O = C2H5OH
1 mol 1 mol
видно что в пропорциях 1 к 1 взаимодействуют реагенты, однако их не равное кол-во, вода в недостатке, C2H4 в избытке, ищем по воде.
8.8 mol x mol
C2H4 + H2O = C2H5OH
1 mol 1 mol
1:8.8 = 1:x
x = 8.8
m(C2H5OH) = 8.8*46 = 404.8 g
Видим что неточный результат(его меньше) поэтому я советую не использовать его когда известны массы реагентов! :)
1)2C2H6O+7O2=4CO2+6H2O
------------------------------------------------------------------------------------------------------
2) в 32 г кислорода содержится 6,02 ×10 ²³ составляем пропорцию:
32 - 6,02 ×10 ²³
480- х= 90,3×10 ²³
х= 6,02 ×10 ²³×480/32=90,3 ×10 ²³= 9,03×10²⁴
ответ:9,03×10²⁴
------------------------------------------------------------------------------------------------------
3)Пишем реакцию
10г х=?
4P +5 O₂= 2P₂O₅
124г 284г
х=284×10/124=22,9г
ответ:22,9г
------------------------------------------------------------------------------------------------------
4)пишем реакцию
10г х=?
4P + 5 O2 =2 P2O5
124г 160г
х=160×10/124=12,9г
ответ:12,9г
------------------------------------------------------------------------------------------------------
5)реакция: 4Al+3O2=2 Al2O3
рассчитываем массы веществ: Mr(4Al)=108г; Mr(2 Al2O3)=204г
делим массу оксида на массу металла:204/108=1,(8)
ответ: в 1,8 раз
------------------------------------------------------------------------------------------------------
6)реакция:
5г 50г х=?
2H2+ O2= 2H2O
4г 32г 36г
х= 36×5/4=45г
ответ:45 г
------------------------------------------------------------------------------------------------------
7)решение на фото
Объяснение:
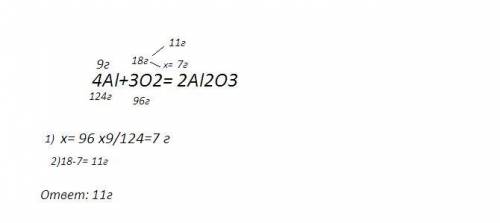
2)zncl2+2naoh=zn(oh)2+2nacl
3)zn(oh)2+h2so4=znso4+2hoh
4)znso4+ba(oh)2=baso4+zn(oh)2
5)cl2+h2=2hcl
6)2hcl+mg=mgcl2+h2
7)mgcl2+ag2so4=2agcl+mgso4