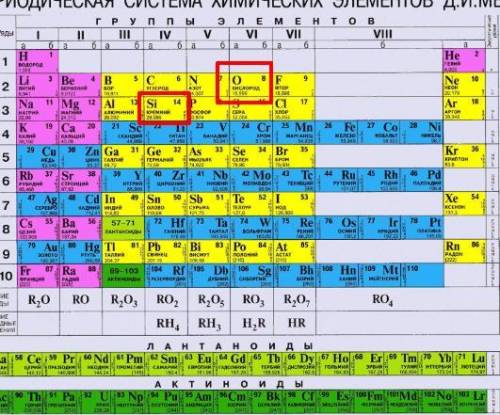
Так уж сложилось что самым электроотрицательным элементом, из известных нашей современной науки, является фтор, ну, и соответственно почетное второе место достается кислороду. Поэтому ответ на ваш вопрос: Электроотрицательность Si меньше электроотрицательности O, поэтому неметаллические свойства Si выражены слабее, чем у O.
В приложении я прикрепил периодическую таблицу Дмитрия Ивановича Менделеева, для того, чтобы объяснить как понять электроотрицательность элементов больше или меньше.
Для этого найдем в таблице фтор(справа от кислорода). Он - самый электроотрицательный, и, легче всего можно сравнивать электроотрицательности можно пользуясь знанием о том, что с уменьшением номера группы элемента, и с увеличением его периода электроотрицательность понижается.
а) m(CO₂) = 88 г;
б) m(CH₄) = 32 г;
в) m(CaCO₃) = 500 г.
Объяснение:
Теперь развернуто решим все 3 задачи, выведем ответ.
а) Дано:
n(CO₂) = 2 моль
m(CO₂) - ?
m=n×M
Рассчитаем молярную массу: M(CO₂) = 12+(16×2) = 44 г/моль
Теперь ищем саму массу вещества: m(CO₂) = 2 моль × 44 г/моль = 88 г.
ответ: m(CO₂) = 88 г.
б) Дано:
V(CH₄) = 44,8 л.
m(CH₄) - ?
m=n×M
n = V/Vm
Напоминаю, что молярный объем - величина постоянная. Она равна 22,4 л.
n(CH₄) = 44,8 л./22,4 л. = 2 моль
Рассчитываем молекулярную массу метана:
M(CH₄) = 12 + 1×4 = 16 г/моль
m(CH₄) = 2 моль × 16 г/моль = 32 г.
ответ: m(CH₄) = 32 г.
в) Дано:
n(CaCO₃) = 5 моль
m(CaCO₃) - ?
m=n×M
Снова нужно рассчитать молярную массу. Молярная масса карбоната кальция рассчитывается так: M(CaCO₃) = 40 + 12 + 16×3 = 100 г/моль.
m(CaCO₃) = 5 моль × 100 г/моль = 500 г.
ответ: m(CaCO₃) = 500 г.
Вывод: Карбонат кальция имеет наибольшую молярную массу среди всех данных соединений. Поэтому его масса (500 г.) наивысшая.
V(р-раNaOH) = 300 мл
W(р-ра NaOH) = 20%
V2(H2O) = 200 мл
Найти:
w2(р-ра)
Решение:
V(NaOH) = V(р-ра NaOH) ∙ w(р-ра) ∙100% = 300 мл ∙ 20%\100% = 60 мл
W2(р-ра) = V(NaOH) ∙ 100%\ V(р-ра NaOH) + V2(Н2О) = 60 мл ∙ 100%\300 мл + 200 мл = 12%
ответ: 12%