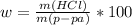
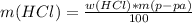 подставляешь все в эту формулу:
подставляешь все в эту формулу: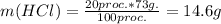 тут g - грамм, proc. - %, программа почему то не распознает русский язык и проценты.
тут g - грамм, proc. - %, программа почему то не распознает русский язык и проценты.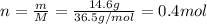 Здесь - mol - это моль
Здесь - mol - это моль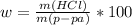
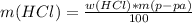 подставляешь все в эту формулу:
подставляешь все в эту формулу: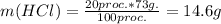 тут g - грамм, proc. - %, программа почему то не распознает русский язык и проценты.
тут g - грамм, proc. - %, программа почему то не распознает русский язык и проценты.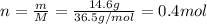 Здесь - mol - это моль
Здесь - mol - это моль
CH3COOH + KOH = CH3COOK + H2O
Так как и в кислоты, и в основания нормальность = молярности, то считаем какое количество вещества уксусной кислоты ушло на реакцию: если в 1000 мл раствора 0,5 моль кислоты, то в 10 мл раствора х моль кислоты. х = 0,5*10/1000 = 0,005 моль.
Столько же ушло и гидроксида калия по реакции, и содержался он в 26 мл раствора.
Считаем нормальность КОН.
Если в 26 мл раствора 0,005 моль КОН, то в 1000 мл х моль. х = 0,005*1000/26 = 0,19 моль/л.
Считаем массу КОН.
Мы определили, что в 1000 мл раствора есть 0,19 моль КОН. Значит в 50 мл раствора х моль КОН. х = 0,19*50/1000 = 0,0095 моль. Считаем массу КОН m = n*M = 0,0095*56 = 0,532 г или 532 мг.
ответ: Сн = 0,19 моль/л; m(KOH) = 532 мг.