5 г х г
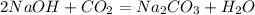
80 г 106 г
1. Сначала найдем чистую массу гидроксида в растворе(просто умножив массу раствора на массовую долю гидроксида в нем):
m(NaOH)=m(раствора)*w(NaOH)=20*0,25=5 г
2. Подставив эту массу в уравнение реакции,и получим массу соли(карбоната натрия):
при взаимодействии 80 г гидроксида получается 106 г карбоната, а
при --//--//-- 5 г_____________________х г, откуда
х=106*5/80=6,625 г
Mg - 2e = Mg⁺² x4 в-ль
S⁺⁶ + 8e = S⁻² x1 о-ль