Гидроксид бария (Ba(OH)2) - это щелочное вещество, которое может вступать в реакции ионного обмена с определенными веществами. Чтобы определить, с какими именно веществами гидроксид бария может реагировать, мы должны рассмотреть ионы, которые он содержит, и ионы, которые могут образовываться в результате ионного обмена.
Гидроксид бария содержит ионы Ba^2+ и OH^-. Ионы Ba^2+ являются положительно заряженными, а ионы OH^- - отрицательно заряженными. В процессе ионного обмена, ионы из одного вещества замещают ионы из другого вещества. В результате образуются новые соединения.
Теперь рассмотрим варианты ответов и определим, с какими веществами гидроксид бария может реагировать.
1. Ba(NO3)2 (нитрат бария) - в данном соединении ионы Ba^2+ и NO3^- (нитрат) связаны ионными связями. При реакции ионного обмена, ионы NO3^- из нитрата бария могут замещаться ионами OH^- из гидроксида бария. В результате образуется новое соединение - гидроксид натрия (NaOH).
2. BaCl2 (хлорид бария) - в данном соединении ионы Ba^2+ и Cl^- (хлорид) связаны ионными связями. Также как и с нитратом бария, ионы Cl^- из хлорида бария могут замещаться ионами OH^- из гидроксида бария. В результате образуется новое соединение - гидроксид хлора (HClO).
3. Na2SO4 (сульфат натрия) - в данном соединении ионы Na^+ и SO4^2- (сульфат) связаны ионными связями. Ионы SO4^2- могут замещаться только ионами OH^- и получиться Ba(OH)2 (гидроксид бария) и Na2SO4 (сульфат натрия).
Исходя из этого, гидроксид бария может вступать в реакции ионного обмена с нитратом бария (Ba(NO3)2), хлоридом бария (BaCl2) и сульфатом натрия (Na2SO4). На рисунке представлены формулы этих веществ, которые я перечислил выше.
Надеюсь, эта информация помогла вам разобраться в задаче. Если у вас есть еще вопросы, не стесняйтесь задавать!
1) Нет, нельзя использовать метод вытеснения воды для сбора оксида серы(VI). Оксид серы(VI) образуется при взаимодействии серы и кислорода, а вода не является достаточно реактивным веществом для вытеснения его из соединения. Уравнение реакции, при которой образуется оксид серы(VI), выглядит следующим образом:
S + O2 -> SO3
2) Чтобы рассчитать объем, занимаемый 5 молями этого газа, мы можем использовать уравнение состояния идеального газа:
V = n * Vm
где V - объем, n - количество молей газа, Vm - молярный объем.
Молярный объем для идеального газа при нормальных условиях (температура 0°C и давление 1 атм) равен приблизительно 22,4 л.
Таким образом, для 5 молей газа объем будет:
V = 5 моль * 22,4 л/моль = 112 л
Таким образом, 5 моль этого газа займут объем в 112 л.
3) Да, аммиак можно собирать с использованием метода вытеснения воздуха. Аммиак образуется при реакции между аммиачной солью и щелочью, и вытесняет воздух из смеси. Уравнение этой реакции выглядит следующим образом:
NH4Cl + NaOH -> NH3 + NaCl + H2O
4) Уравнения реакций взаимодействия аммиака NH3 с указанными кислотами выглядят следующим образом:
NH3 + HBr -> NH4Br
NH3 + HNO3 -> NH4NO3
NH3 + H3PO4 -> (NH4)3PO4
5) Углекислый газ (СО2) можно получить из карбоната натрия (Na2CO3) и серной кислоты (H2SO4) путем реакции:
ну раз W(H2O)=44.8%
значит W(NiSO4)=55.2%
M(NiSO4)=155г/моль
значит M(NiSO4*nH2O)=155/0.552=280.8г/моль
n=(280.8-155)/18=7
формула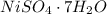
следовательно 1 моль кристаллогидрата содержит 7 моль воды