Дано: Zn + 2HCl =ZnCl2 + H2
m(Zn)13г 13г х г
m(H2)-? 1моль 1моль
65г/моль 2г/моль
13-х
65-2
х=13*2/65=0,4г
ответ:m(H2)=0,4г
Воспользуемся формулой: 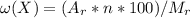
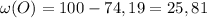 %
%
Из формулы выразим : 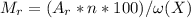 , здесь Mr - молярная масса вещества, Ar - атомная масса элемента,входящего в вещество, n - число атомов элемента в веществе, w(x) - процентное содержание элемента в веществе
, здесь Mr - молярная масса вещества, Ar - атомная масса элемента,входящего в вещество, n - число атомов элемента в веществе, w(x) - процентное содержание элемента в веществе
Найдём молярную массу вещества: 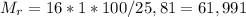 г/моль
г/моль
Молярная масса складывается из атомных масс - вычтем атомную массу кислорода, чтобы найти атомную массу интересующего нас металла: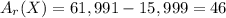 г/моль
г/моль
Но, так как сказано, что элемент первой группы, значит в оксиде число его атомов =2, т.е чтобы получилась атомная масса 1 атома, разделим полученное значение на 2:
46/2 = 23 г/моль
Смотрим по таблице Менделеева, да, это натрий(Na) - одиннадцатый элемент.
Атом натрия имеет следующую конфигурацию: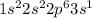
Оксиду натрия Na2O соответствуем гидроксид NaOH, который проявляет типичные основные свойства:
NaOH + HCl = NaCl + H2O
NaOH + AL(OH)3 = Na[Al(OH)4]
NaOH + CuSO4 = Cu(OH)2 + Na2SO4
2)Имеется раствор(смесь), содержащий Нитраты: натрия, бария, Меди, Свинца, и Цинка.
Разделите данную смесь выделив соединения каждого элемента в индивидуальном состоянии.
3)Смесь Газообразных Хлора и Хлороводорода объемом 22.4 л пропустили над нагретыми Железными опилками. Масса опилок увеличилась при этом на 42,6 г. Определите состав исходной смеси.
4)Если к Смеси Порошков двух простых веществ А(Темно - фиолетовый) и Б(Серебристо - Белый) добавить Несколько капель Жидкости В, то произойдет бурная реакция образования вещества Г. Если Вещество Г растворять в Избытке раствора Гидроксида Натрия, то получается прозрачный раствор. При пропускании в Этот раствор Хлора, Выпадает Белый осадок Д, а раствор окрашивается в Бурый Цвет. Если же вещество Г попытаться Растворить в растворе Аммиака, то Осадок Д выпадает Сразу же. Определить все вещества