Умники, решите, что можете. и не читерите, рил нужно а-1. формулы только оснований в ряду: 1) нсl, nacl, hno3; 2) h2so3, h2so4, h2s; 3) ca(oh)2, naoh, al(oh)3; 4) na2o, nano3, hno3. а-2. формулы только щелочей в ряду 1) fe(oh)2, koh, ва(он)2; 2) naoh, ca(oh)2, cu(oh)2; 3) koh, naoh, lioh; 4) fe(oh)3, cu(oh)2, naoh. a-3. оксид, который реагирует с гидроксидом калия, образуя соль,— это 1) fe2o3; 2) к2о; 3) so3; 4) bao. a-4. взаимодействие металла с кислотой относится к реакциям 1) соединения; 2) обмена; 3) разложения; 4) замещения. а-5. взаимодействие гидроксида натрия с серной кислотой относится к реакциям: 1) соединения; 2) разложения; 3) замещения; 4) обмена. а-6. индикатор фенолфталеин в кислой среде: 1) бесцветный; 2) малиновый; 3) красный; 4) желтый. а-7. свойство, которое является общим для нерастворимых оснований и щелочей, - это: 1) взаимодействие с кислотными 2) взаимодействие с кислотами 3) взаимодействие с солями 4) разложение в-8. даны формулы веществ: feo, k2o, co2, mgo, cro, cro3, so2, р2о5 выпишите формулы только кислотных оксидов. ответ: в-9. установите соответствие между формулой вещества и классом неорганических соединений, к которому оно принадлежит. 1) cuo а. кислоты 2) н2sо4 б. щелочи 3) fе(он)2 в. оксиды 4) кoh г. нерастворимые основания ; ; ; в-10. установите соответствие между исходными веществами и продуктами реакций. 1) hgo + hno3 a. al2(so4)3 + н2 2) al + h2so4 б. k3ро4 + н2о 3) na2o + co2 + h2o b. hg(no3)2+ н2о 4) k2o + h3po4 г. na2co3 + н2о ; ; ; в-11. вставьте в схемы реакций недостающие формулы веществ. 1) + → mgсl2 + н2о; 2) + → mgso4 + н2; 3) + → k3ро4 + н2о; 4) + → na2s + н2о. в-12. допишите уравнения реакций. 1) liон + so3 →….. +….; 2) naoh + р2о5 → ….. + …..; 3) са(он)2 + со2 →…..+ …; 4) ва(он)2 + so2 → …+ …. с-13. даны вещества: соляная кислота, гидроксид калия, вода, оксид фосфора(v), оксид магния. с какими из перечисленных веществ может взаимодействовать гидроксид натрия? напишите уравнения соответствующих реакций. укажите тип каждой реакции. с-14. как отмыть пробирку от остатков нерастворимого в воде основания? с-15. составьте уравнения реакций, соответствующих схеме р→х→н3ро4 │ nа3ро4
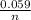 *lg[Zn²⁺], здесь n - некий электрохимический эквивалент, равный числу отданных(принятых электронов) численно равен заряду иона. Для цинка:
*lg[Zn²⁺], здесь n - некий электрохимический эквивалент, равный числу отданных(принятых электронов) численно равен заряду иона. Для цинка: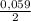 *lg(0.001) = -0,6745(счет расписывать не буду)
*lg(0.001) = -0,6745(счет расписывать не буду)
ответ: а-1 ответ 3)
объяснение: