Кальций — типичный щёлочноземельный металл. Химическая активность кальция высока, но ниже, чем более тяжёлых щёлочноземельных металлов. Он легко взаимодействует с кислородом, углекислым газом и влагой воздуха, из-за чего поверхность металлического кальция обычно тускло серая, поэтому в лаборатории кальций обычно хранят, как и другие щёлочноземельные металлы, в плотно закрытой банке под слоем керосина или жидкого парафина.
В ряду стандартных потенциалов кальций расположен слева от водорода. Стандартный электродный потенциал пары Ca2+/Ca0 −2,84 В, так что кальций активно реагирует с водой, но без воспламенения:
Ca + 2Н2О → Ca(ОН) 2 + Н2↑ + Q.
С активными неметаллами (кислородом, хлором, бромом) кальций реагирует при обычных условиях:
2Са + О2 → 2СаО
Са + Br2 → CaBr2.
При нагревании на воздухе или в кислороде кальций воспламеняется. С менее активными неметаллами (водородом, бором, углеродом, кремнием, азотом, фосфором и другими) кальций вступает во взаимодействие при нагревании, например:
Са + Н2 → СаН2, Ca + 6B = CaB6,
3Ca + N2 → Ca3N2, Са + 2С → СаС2,
3Са + 2Р → Са3Р2 (фосфид кальция) , известны также фосфиды кальция составов СаР и СаР5;
2Ca + Si → Ca2Si (силицид кальция) , известны также силициды кальция составов CaSi, Ca3Si4 и CaSi2.
Протекание указанных выше реакций, как правило, сопровождается выделением большого количества теплоты (то есть эти реакции — экзотермические) . Во всех соединениях с неметаллами степень окисления кальция +2. Большинство из соединений кальция с неметаллами легко разлагается водой, например:
СаН2 + 2Н2О → Са (ОН) 2 + 2Н2↑,
Ca3N2 + 6Н2О → 3Са (ОН) 2 + 2NH3↑.
Ион Ca2+ бесцветен. При внесении в пламя растворимых солей кальция пламя окрашивается в кирпично-красный цвет.
Такие соли кальция, как хлорид CaCl2, бромид CaBr2, иодид CaI2 и нитрат Ca(NO3)2, хорошо растворимы в воде. Нерастворимы в воде фторид CaF2, карбонат CaCO3, сульфат CaSO4, ортофосфат Ca3(PO4)2, оксалат СаС2О4 и некоторые другие.
Важное значение имеет то обстоятельство, что, в отличие от карбоната кальция СаСО3, кислый карбонат кальция (гидрокарбонат) Са (НСО3)2 в воде растворим. В природе это приводит к следующим процессам. Когда холодная дождевая или речная вода, насыщенная углекислым газом, проникает под землю и попадает на известняки, то наблюдается их растворение:
СаСО3 + СО2 + Н2О → Са (НСО3)2.
В тех же местах, где вода, насыщенная гидрокарбонатом кальция, выходит на поверхность земли и нагревается солнечными лучами, протекает обратная реакция:
Са (НСО3)2 → СаСО3 + СО2↑ + Н2О.
1. а) 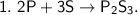
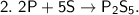
Это реакции соединения, так как из нескольких веществ образуются одни новые вещества, более сложные 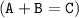 .
.
б) 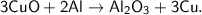
Это реакция замещения, так как из одного простого и одного сложного веществ образуется одно новое простое и одно новое сложное вещества 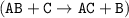 .
.
в) 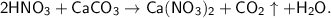
Это реакция [ионного] обмена, так как из двух сложных веществ образуются два новых сложных вещества 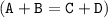 . На самом деле сначала образуется не CO₂ + H₂O, а неустойчивая угольная кислота - H₂CO₃, которая впоследствии и разлагается на CO₂ и H₂O.
. На самом деле сначала образуется не CO₂ + H₂O, а неустойчивая угольная кислота - H₂CO₃, которая впоследствии и разлагается на CO₂ и H₂O.
г) 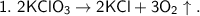
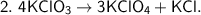
Это реакции разложения, так как из одних сложных веществ образовалось несколько новых веществ, более простых  .
.
д) 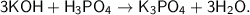
Это реакция [ионного] обмена, так как из двух сложных веществ образуются два новых сложных вещества  .
.
2. а) 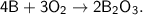
б) 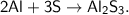
Fe- его атомный номер равен 26, заряд ядра 26+
Но масса одного железа-54, а другого 56,это и есть нуклиды