 моль
моль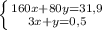
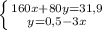

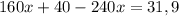

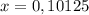 моль (это количество вещества Fe₂O₃)
моль (это количество вещества Fe₂O₃)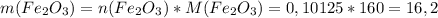 г
г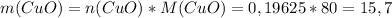 г
г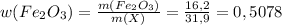 или 50,78% (где m(X) - это масса смеси)
или 50,78% (где m(X) - это масса смеси)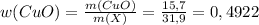 или 49,22%
или 49,22%1) Если массовая доля элемента в оксиде 65,2%, то массовая доля кислорода в оксиде 100 - 65,2 = 34,8%.
2) Если валентность элемента равна 5, то формула его высшего оксида - Э₂О₅.
3) Возьмем 1 моль данного оксида. Так как в молекуле 5 атомов кислорода, то в 1 моле оксида на кислород приходится 16*5 = 80г.
Составляем пропорцию:
80 г 34,8%
Х г 65,2%
Х = 80*65,2/34,8 = 149,88 г
4) Так как в молекуле оксида 2 атома элемента, то атомная масса элемента равна:
149,88/2 = 74,94
Смотрим в таблицу Менделеева: такую атомную массу имеет мышьяк - As
Ну, для начала запишем формулы:
Сульфид железа (III) - Fe2S3
Кремниевая кислота (метакремниевая кислота) - H2SiO3
Оксид серы (IV) - SO2
Оксид кремния (IV) - SiO2
Вспомним определение электролитической диссоциации - это процесс распада электролита на ионы, при расплавлении или растворении его в воде.
Значит, электролитической диссоциации подвергаются РАСТВОРИМЫЕ вещества (в таблице растворимости соединения, которые отмечены буквами Р и М. Соединения с буквой Н - диссоциации не подвергаются!).
Проверим данные вещества на растворимость:
Fe2S3 - нерастворим (диссоциировать не будет!)
H2SiO3 - нерастворима (диссоциировать не будет!)
SO2 - это вообще оксид, это не электролит (диссоциировать не будет!)
SiO2 - это вообще оксид, это не электролит (диссоциировать не будет!)
Грубо говоря, из этого списка веществ - ни одно подвергаться диссоциации не будет!