1.Пространство вокруг ядра, где наиболее вероятно нахождение электрона, называется орбиталью этого электрона, или электронным облаком.
2.Электроны, облака которых в атоме совместились, называют спаренными, а несовмещённые – неспаренными.
3.Форма электронных облаков. Электронное облако не имеет резко очерченных границ в пространстве, поэтому представления о размерах и форме электронного облака требуют специального пояснения. Электронное облако атома водорода. В этом облаке можно провести поверхности, на которых электронная плотность будет иметь одинаковое значение. В случае атома водорода это сферические поверхности, внутри которых заключена большая или меньшая часть электронного облака. Если проведённая поверхность охватывает 90 % заряда и массы электрона, её называют граничной поверхностью. Размер и форму граничной поверхности отождествляют с размером и формой электронного облака. Рассмотрим зависимость вероятности W* пребывания электрона в данной точке пространства от её отдалённости от ядра r на примере 1s-электрона атома водорода. Цифра 1 показывает, что главное квантовое число n = 1, а буква s — равенство нулю его орбитального квантового числа: l = 0. Из рис. 7 следует, что вероятность обнаружения электрона на малых расстояниях от ядра, так же, как и на больших, близка к нулю. На некотором расстоянии от ядра r0 вероятность нахождения электрона максимальна. Для атома водорода это расстояние точно совпадает с радиусом первой боровской орбиты и равно 0,053 нм. Однако следует иметь в виду, что, по Бору, эта величина показывает, на каком расстоянии от ядра электрон находится, а по представлениям квантовой механики это расстояние отвечает максимальной вероятности обнаружения электрона. Следовательно, в отличие от модели атома по Бору, электрон может находиться и на других расстояниях от ядра — как меньших, так и больших 0,053 нм. Характер зависимости W от r для 1s-электрона свидетельствует о том, что электронное облако 1s-электрона обладает сферической симметрией, т. е. имеет форму шара с ядром в центре. s-Электроны с главным квантовым числом n, равным 2, 3, 4 ...также обладают сферической симметрией. По мере того, как главное квантовое число возрастает, расстояние наиболее вероятного пребывания электрона от ядра также увеличивается, и электронное облако становится более размытым. На рис. 8 схематически показано электронное облако 2s-орбитали (2s-электрона) . Для 2p-электронов (главное квантовое число n = 2, орбитальное квантовое число l = 1) кривая зависимости вероятности обнаружения электрона W от расстояния r имеет максимум (рис. 9). Такому распределению вероятности обнаружения 2p-электрона соответствует форма электронного облака, напоминающая двойную грушу или восьмёрку. Магнитное квантовое число 2p-электронов может иметь три значения: –1, 0 и +1, что соответствует ориентации восьмёрки вдоль трёх координатных осей: x, y, z. Иными словами, три p-электронных облака ориентированы в пространстве во взаимно перпендикулярных направлениях. Поэтому три 2p-электронных облака обозначают так: 2px, 2py, 2pz. Электроны всех трёх 2p-орбиталей имеют одинаковую энергию. Как и в случае s-электронов, p-орбитали становятся более размытыми, когда главное квантовое число возрастает, однако сохраняют ту же симметрию — подобны восьмёрке. Для 3d-электронов (главное квантовое число n = 3, орбитальное квантовое число l = 2) возможны пять вариантов пространственного расположения электронного облака, отвечающие пяти значениям магнитного квантового числа m: –2, –1, 0, +1, +2. Все электроны 3d-орбиталей имеют одинаковую энергию.
Объяснение:
Электронно-графическая формула атома серы S⁰ в нормальном состоянии:
Формула: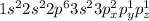
Валентность: II
Электронно-графическая формула атома серы S⁰ в возбуждённом состоянии:
Когда атом получает дополнительную энергию, он переходит в возбуждённое состояние, и его валентные электроны распариваются и переходят на более высокий энергетический уровень. Формулы следующие:
Формула: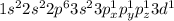
Валентность: IV
Формула: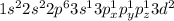
Валентность: VI