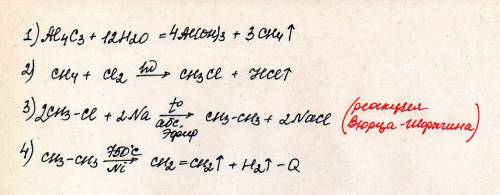
А что пару...пару мало как - то) Держи все)
Задачка №1:
1) Рассчитаем массы растворенных веществ в рнастворе 1 и в растворе 2 - обозначим их m1 и m2. Массы растоворов обозначим соответственно M1 и M2
m1 = w*M1 = 200 грамм*0,1 = 20 грамм
m2 = w*M2 = 340 грамм*0,16 = 54,4 грамма
2) M3 - это масса третьего раствора, она будет складываться из массы первого раствора и массы второго раствора:
M3 = M1 + M2 = 200 + 340 = 540 грамм
3) m3 - это масса растворенного вещества соли в растворе, она будет складываться из массы растворенного вещества соли в первом растворе и массы растворенного вещества соли во втором растворе:
m3 = m1 + m2 = 20 + 54.4 = 74.4 грамма
4) w=m3/M3*100% - здесь все ясно
w = 74.4/540*100=13.7%
Задачка №2
Уравнение для начала:
2Fe + 3Cl2 = 2FeCl3
1 - задача явно на избыток и недостаток, так как нам дана информация по двум исходным веществам, для того чтобы определить кто из них кто, найдем их количества вещества:
n(Fe)=m/M=100грамм/56г/моль=1,8 моль
n(Cl) =V/Vm = 67,2л/22,4л/моль=3 моль
Видно, что железо в недостатке, а хлор в избытке, зачем нам это знать, мы знаем, что реакция идет до конца, если все вещества реагируют полностью, так вот, то вещество которое в недостактке 100% прореагирует полностью.
2 - По уравнению реакции - n(FeCl3) = n(Fe) = 1.8 моль
3 - m(FeCl3) = 1.8моль*162,5г/моль=292,5 грамма
Задание №3:
а - 3
б - 5
в - 2
г - 1
ZnS+2HCI→ZnCI2+H2S 2H2S+3O2→2SO2+2H2O
S⁻² -6e S⁺⁴ 2 вост-ль
02⁰ +4e 2O⁻² 3 окисл
2SO2+O2→2SO3
S⁺⁴ -2e S⁺⁶ вост
02⁰ +4e 2O⁻² окисл
SO3+2NaOH→Na2SO4+H2O Na2So4+2HCI→2NaCI+H2SO4
6HCl+2NHO3→3Cl2+2NO+4H2O
2CI⁻, +2e, CI2⁰ 3 вост
N⁺5 -3e, N⁺² 2 ок
3Cl2+6KOH →5KCl+KClO3+3H2O
CI2⁰ -5e 2СI⁺5, вс
CI2⁰ -2e 2СI ⁻ ок, 112л
СаСO3→CaO+CO2
100г/моль 22,4 л/моль
5моль 5 моль m/CaCO3/ 100 гр
80%, значит 80 гр