8,1 г Х л
2Al + 2 NaOH + 6H2O -> 2Na[Al(OH)4] + 3H2
n = 2 моль n=3 моль
М = 27 г/моль Vm=22,4 л/моль
m = 54 г V = 67,2 л
8,1 г Al - Х л Н2
54 г Al - 67,2 л Н2
V(H2) = 8,1 * 67,2 / 54 = 10,08 л
1) В пределах одной группы металлические свойства возрастают при увеличении порядкового номера элемента. Это связано с увеличением радиуса атома и более легким отхождением электронов от ядра.
ОТВЕТ: а)
2) Имея только один электрон на внешнем энергетическом уровне, элемент может иметь валентность только 1, соответственно может содержать только одну ОН группу и два атома на кислород в окисде.
ОТВЕТ: в)
3) Как уже было сказано в первом номере, в одной группе радиус атома увеличивается с увеличением его порядкового номера.
ОТВЕТ: г)
4) Щелочные металлы невероятно активны, и всячески стремятся перейти в устойчивую для себя форму иона, с зарядом +1. Поэтому в свободной форме в природе не встречаются и окислительных свойств не проявляют почти совсем, а восстановительных в степени окисления +1 в принципе не могут проявлять, но что правда про них, это то, что их действительно почти все можно спокойно резать ножом и намазывать на хлеб, главное потом не есть)
ОТВЕТ: в)
5) Реакция натрия с водой невероятно экзотермична. Натрий как бешеный носится по поверхности и искрит. В то же время это является реакцией замещения водорода на натрий. Продуктом реакции является щелочь.
ОТВЕТ: в)
6) Основные свойства щелочей тем выше, чем активнее металл, входящий в соединение наиболее активным металлом является литий.
ОТВЕТ: а)
7) С раствором щелочи точно не могут взаимодействовать основные соединения. Могут лишь кислотные и амфотерные. Могут таже растворимые соли, если в результате реакции получается нерастворимвый гидроксид.
ОТВЕТ: б)
8) Соли натрия содержает его ионы. Ионы натрия окрашивают пламя горелки в желтый цвет.
ОТВЕТ: г)
9) Каустическая сода (она же едкий натр) - тривиальное название гидроксида натрия
ОТВЕТ: в)
10) Хлорид соединие вида 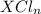 , сульфид
, сульфид 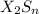 , гидрид
, гидрид 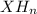 .
.
ОТВЕТ: в)
Важнейшими признаками, которые положены в основу современной классификации органических соединений, являются строение углеродной цепи и природа функциональных групп.
Классификация по строению углеродной цепи. В зависимости от расположения углеродных атомов в молекуле органические соединения делят на несколько больших групп.
Органические соединения
Ациклические (алифатические)
Циклические
Карбоциклические Гетероциклические
Ароматические Алициклические
различают два типа органических соединений, ациклические и циклические.
Количество вещества алюминия = m (масса 8,1г) / М (молярная масса 27 г/моль) = 0,3 моль
Из уравнения реакции: количество вещества алюминия относится к количеству вещества (Н2) = 2 : 3, т.е 1:1,5 (получили при сокращении) ==> количество вещества (Н2) больше в 1,5 раза ==> равно: 0,3 моль*1,5 = 0,45 моль.
V (Н2) = количество вещества (0,45 моль)*Vm (22,4 л/моль (постоянное)) = 10,08 л