1) Уравнение р-ии Si со смесью HNO3 и HF с полным переводом Si в H2[SiF6]:
3Si + 4HNO3 (M = 63 г/моль) + 18HF (M = 20 г/моль) = 3H2[SiF6] + 4NO + 8H2O;
2) нах-м массы HNO3 и HF соот-но: 42 г Si сос-т 42/28 = 1.5 моль и в соот-ии с ур-м р-ии масса HNO3 сос-т 1.5*(4/3)*63 = 126 г, а масса HF - соот-но 1.5*(18/3)*20 = 180 г;
3) нах-м массы и объемы р-ов HNO3 и HF соот-но: m р-ра HNO3 сос-т 126/0.6 = 210 г, объем - 210/1.367 = 153.621 см^3; m р-ра HF сос-т 180/0.3 = 600 г, объем - 600/1.102 = 544.4646 см^3;
4) т.о. соот-ие объемов р-ов HNO3 и HF сос-т 153.621:544.4646 = 1:3.5442.
3,68 г 4,48 г
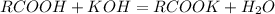
х г 56 г
1. Определим относительную молекулярную массу кислоты:
для полной нейтрализации кислоты 3,68 г необходимо 4,48 г гидроксида, а
для --//--//-- х г____________56 г, откуда
х=3,68*56/4,48=46 г(в одном моле)
2.Подставив эту цифру в формулу по вычислению молекулярной массы,получим: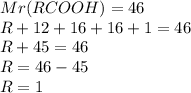
Радикал,который имеет относительную массу 1 - это Водород,значит это первый представитель гомологов односновных предельных карбоновых кислот-муравьиная кислота - 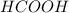
n=m/M
M(SO2)=32+2*16=64(г/моль)
n=128/64=2(моль)
N=n*Na, где Na - число Авагадро = 6.02*10^23 (г/моль)
N=2*6.02*10^23=12.04*10^23(молекул)
m=8(г)
M(NaOH)=23+16+1=40 (г/моль)
n=m/M=8/40=2 (моль)
N=2*6.02*10^23=12.04*10^23 (молекул)