
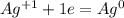 |*2 восстановление, серебро в AgNO3 - окислитель
|*2 восстановление, серебро в AgNO3 - окислитель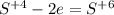 |*1 окисление, сера в Na2SO3 - восстановитель
|*1 окисление, сера в Na2SO3 - восстановитель 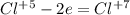 |*3 окисление, хлор в KC1O3 -восстановитель
|*3 окисление, хлор в KC1O3 -восстановитель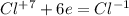 |*1 восстановление, хлор в KC1O3 - окислитель
|*1 восстановление, хлор в KC1O3 - окислитель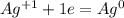 |*2 восстановление, серебро в AgNO3 - окислитель
|*2 восстановление, серебро в AgNO3 - окислитель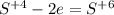 |*1 окисление, сера в Na2SO3 - восстановитель
|*1 окисление, сера в Na2SO3 - восстановитель 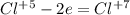 |*3 окисление, хлор в KC1O3 -восстановитель
|*3 окисление, хлор в KC1O3 -восстановитель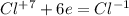 |*1 восстановление, хлор в KC1O3 - окислитель
|*1 восстановление, хлор в KC1O3 - окислитель
2. находим сколько хлороводорода можно получить из данной массы хлорида натрия (масса теоретическая)
NaCl + H2SO4 = NaHSO4 + HCl
n(HCl) = n(NaCl); n(NaCl) = 895 кг/58,5 кг/кмоль = 15,3 кмоль;
3. находим количество хлороводорода, затраченного на получение кислоты. n=V*ρ*ω/M = 1250л*0,37*1,19 кг/л/36,5 кг/кмоль =15,078 кмоль;
4. находим выход хлороводорода. ω(HCl) = 15,078 rкмоль/15,3 кмоль = 0,9855 = 98,55%