22,4
Объяснение:
Дано:
m(CaO) = 112 г
Найти:
V(O₂) = ?
Реакция: 2Ca + O₂ → 2CaO
Сначала находим количество вещества оксида кальция:
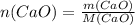 , где M(CaO) - молярная масса CaO, которая считается как сумма атомных масс Ca и O (даны в таблице Менделеева)
, где M(CaO) - молярная масса CaO, которая считается как сумма атомных масс Ca и O (даны в таблице Менделеева)
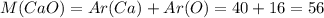 г/моль
г/моль
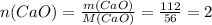 моль
моль
По реакции видно, что оксида кальция в 2 раза больше, чем затраченного кислорода (по коэффициентам смотрим: у CaO 2, у O₂ 1). Поэтому и количество вещества у кислорода будет в 2 раза меньше, чем у оксида кальция:
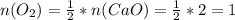 моль
моль
Объем считаем по формуле:
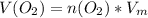 , где
, где 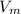 - молярный объем, который для всех газов при н.у. равен 22,4 л/моль.
- молярный объем, который для всех газов при н.у. равен 22,4 л/моль.
Подставляем и решаем:
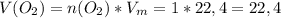 л
л
ответ: 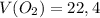 л
л
добавить в каждую цинк – где происходит выделение газа – там серная кислота. Эту пробирку убрать от остальных
Zn+H2SO4 = ZnSO4 + H2
добавиь растовримую соль бария – выпал осадок сульфат аммония
(NH4)2SO4 + BaCl2 = BaSO4 (осадок белый не растворим в азотной кислоте) + 2NH4Cl
осталась 3 пробирка, там нитрат аммония (методом исключения.) т.к нитрат в растворе – не доказат, только кристаллический можно
доказать аммоний можно если прилить к каждой щелочь – где появился запах аммика – там сульфата аммония
(NH4)2SO4 + 2NaOH = Na2SO4 + NH3 + H2O
2) 2NaNО3 = 2NaNО2 + О2
3) Cl2 + Н2О = НСl + НСlО