1. соляная кислота + оксид магния → хлорид магния + вода
2HCl + MgO → MgCl₂ + H₂O
2H⁺ + 2Cl⁻ + MgO → Mg²⁺ + 2Cl⁻ + H₂O
2H⁺ + MgO → Mg²⁺ + H₂O
2. серная кислота + цинк → сульфат цинка + водород
H₂SO₄ + Zn → ZnSO₄ + H₂↑
2H⁺ + SO₄²⁻ + Zn → Zn²⁺ + SO₄²⁻ + H₂↑
2H⁺ + Zn → Zn²⁺ + H₂↑
3. соляная кислота + гидроксид натрия → хлорид натрия + вода
HCl + NaOH → NaCl + H₂O
H⁺ + Cl⁻ + Na⁺ + OH⁻ → Na⁺ + Cl⁻ + H₂O
H⁺ + OH⁻ → H₂O
4. хлорид натрия + серная кислота → гидросульфат натрия + хлороводород
NaCl + H₂SO₄ → NaHSO₄ + HCl↑
Na⁺ + Cl⁻ + 2H⁺ + SO₄²⁻ → Na⁺ + HSO₄⁻ + H⁺ + Cl⁻
H⁺ + SO₄²⁻ → HSO₄⁻
Дано:
m(раствора NaOH=80г
ω%(NaCI)=8%
------------------------------------
m(осадка)-?
1. Определим массу гидроксида натрия в 80г. 8% раствора:
m(NaOH)=ω%(NaOH)×m(раствора NaOH)÷100%
m(NaOH)=8%×80г.÷100%=6,4г.
2. Определим молярную массу гидроксида натрия:
M(NaOH)=23+16+1=40г./моль
3. Определим количество вещества гидроксида натрия в 6,4г.:
n(NaOH)=6,4г.÷40г./моль=0,16моль
4. Запишем уравнение реакции:
3NaOH + Fe(NO₃)₃ = 3NaNO₃ + Fe(OH)₃↓
по уравнению реакции из 3моль гидроксида натрия образуется 1 моль гидроксида железа(lll);
по условию задачи гидроксида натрия 0,16моль, значит образуется в три раза меньше моль гидроксида железа(lll)
n[Fe(OH)₃]=0,16моль÷3мольх1моль=0,05моль
5. Определим молярную массу гидроксида железа(lll):
M[Fe(OH)₃]=56+(16+1)×3=107г./моль
6. Определим массу гидроксида железа(lll) количеством вещества 0,05моль:
m[Fe(OH)₃]=n[Fe(OH)₃]×M[Fe(OH)₃]
m[Fe(OH)₃]=0,05моль×107г./моль=5,35г.
7. ответ: масса осадка гидроксида железа(lll) 5,35г.
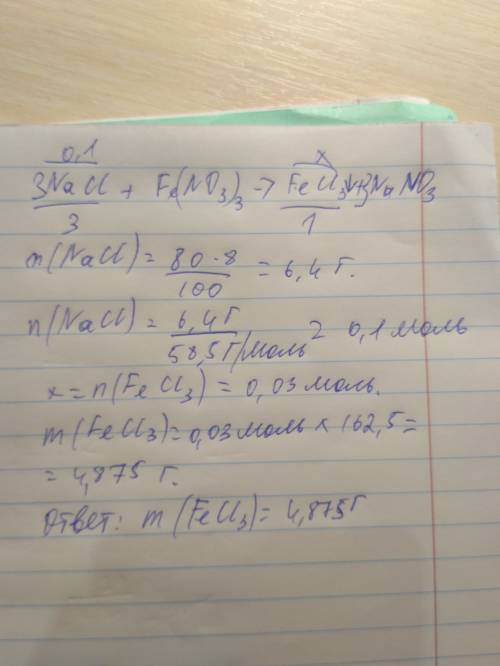
Р2О5 + 3СаО = Са3(РО4)2
Р2О5 + 3Са (ОН) 2 = Са3(РО4)2 + 3Н2О.