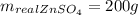
Объяснение:
Начнем решение с составления уравнения, нам не известно какая по концентрации кислота, однако это и не имеет значения ибо во всех уравнениях коэффициенты перед цинком и сульфатом цинка одинаковы для разбавленной (1) и концентрированных (2, 3) кислот
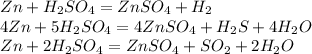
Поэтому возьмём с разбавленной (1):
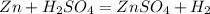
Итак посчитаем количество чистого цинка в смеси, так как примесей 10%, то чистого вещества 90%:
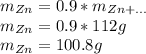
Найдем количество вещества цинка, для этого массу разделим на молярную массу:
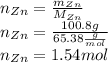
Количество сульфата цинка равно количеству цинка, так как коэффициенты в реакции равны 1 и 1 соответственно, значит теоретическое количество сульфата цинка тоже равно 1.54 моль
Найдем теоретическую массу сульфата цинка, для этого количество вещества умножим на молярную массу:
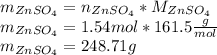
Найдем практическую массу, для этого теоретическую массу умножим на выход реакции:
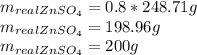

Объяснение:
Щелочные металлы находятся в 1 группе ПСХЭ, следовательно наш металл одновалентен, запишем уравнение реакции

Найдем количество вещества водорода, для этого объём разделим на молярный объём:

Из стехиометрических коэффициентов видно что количество металла в 2 раза больше чем количество водорода, ведь коэффициенты относятся как 1 : 2, значит количество металла равно 0.2mol * 2 = 0.4mol
Количество вещества равно массе вещества деленной на его молярную массу, запишем формулу и выразим неизвестное (M):

Этот металл согласно ПСХЭ - натрий (Na)