Даны схемы реакций: а) гидроксид меди (ii) → оксид меди (ii) + вода; б) хлорид бария + сульфат натрия → сульфат бария + хлорид натрия; в) серная кислота + магний → сульфат магния + водород; г) оксид углерода (iv) + вода → угольная кислота. запишите уравнения реакций, укажите типы реакций.
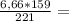 4,8г
4,8г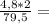 0,12г
0,12г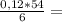 1,08г
1,08г
BaCl2 + Na2SO4 -> BaSO4 + 2NaCl обмен
H2SO4 + Mg -> MgSO4 + H2 замещение
CO2 + H2O -> H2CO3 соединение