Задача сложная, но банальная:D
Уравнение реакции:
K2CO3 + ZnCl2 = 2KCl + ZnCO3(осад.)
Рассчитаем количество вещества карбоната калия(с молярной концентрации):
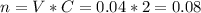 моль
моль
Рассчитаем количество вещества хлорида цинка(я рассчитываю сразу, подставляя и плотность и объем и массовую долю, дела на молярную массу):
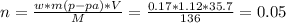 моль
моль
Видим,что карбонат калия в избытке, в количестве:0,08 - 0,05 = 0,03 моль
Рассчитаем массу избыточного карбоната калия:
m = n*M = 0,03моль*138г/моль = 4,14г
По уравнению реакции:
n(KCl) = 2n(ZnCl2) = 0,05моль*2 = 0,1моль
Рассчитаем массу хлорида калия:
m = n*M = 0,1моль*74,5г/моль = 7,45г
По уравнению реакции:
n(ZnCO3) = n(ZnCl2) = 0,05моль
Рассчитаем массу карбоната цинка:
m = n*m = 0,05моль*125г/моль = 6,25г
Рассчитаем массу получившегося раствора:
m(р-ра) = m(р-ра K2CO3) + m(р-ра ZnCl2) - m(ZnCO3) = ((1,3г/мл*40мл) + (35,7мл*1,12г/мл) - 6,25г = 85,75г
Рассчитаем массовые доли хлорида калия и непрореагировавшего карбоната калия:
w(KCl) = 7,45г/85,75г*100% = 8,68%
w(K2CO3) = 4,14г/85,75г*100% = 4,82%
Не сложная задачка.
Уранения реакций:
HCOOC2H5 + NaOH = HCOONa + C2H5OH
CH3COOC2H5 + NaOH = CH3COONa + C2H5OH
Рассчитаем количество вещества гидроксида натрия:
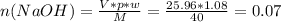 моль
моль
Пусть в реакцию вступает х моль этилового эфира муравьиной кислоты
Пусть в реакцию вступает у моль этилового эфира уксусной кислоты
Тогда, массу смеси эфиров можно математически представить как следующее выражение:
74х + 88у = 5,6 , здесь 74 - молярная массу уксусного эфира, 88 - молярная масса уксусного эфира уксусной кислоты
По уравнению реакции:
n(NaOH) = n(HCOOC2H5) = х моль
n(NaOH) = n(CH3COOC2H5) = у моль
Составим систему уравнений:
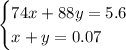
Домножим второе уравнение системы на 74, получим:
74x + 88y = 5.6
74x + 74y = 5.18
Вычтем из первого уравнения второе:
14y = 0.42
y = 0.03
х = 0,07 - 0,03 = 0,04
Рассчитаем массу уксуснометилового эфира:
m = n*M = 0,04*74 = 2,96г
Рассчитаем массу уксусноэтилового эфира:
m = n*m = 0,03*88 = 2,64г
И 500-200=300 г води