1. В переводе с китайского название этого распространенного минерала, силиката, означает "высокий холм".
К А О Л И Н
2. Название этого простого вещества, с которым мы часто сталкиваемся в повседневной практике, фармацевты и химики пишут по-разному.
Й О Д
*I2 - простое вещество.
3. Один из элементов, "рождающих медь".
Бинарное кислородное соединение металла.
Т Е Л Л У Р
*Элементы "рождающие медь" расположены в VI группе. В ней же находится элемент теллур.
4. Перевод названия этого металла с греческого означает "свинец", "свинцовый". Этим словом в Древней Греции обозначали и сульфид свинца, и многие другие минералы, оставляющие черный след на бумаге, в том числе и графит.
М О Л И Б Д Е Н
5. Данный состав бывает часто необходим нам в быту. У слова, которым он обозначается в русском языке, есть созвучные слова, паронимы, во многих европейских языках. Например, в переводе с нидерландского это "глина".
К Л Е Й
*На нидерландском klei - глина.
6. У этого слова много "родственников": анатомия, томография, дихотомия...
А Т О М
*Все эти слова объединяет частица "том".
8. "Египетская черная магия".
А Л Х И М И Я
1) 6I₂ + 12NaOH →10 NaI + 2NaIO₃ + 6H₂O ; реакция диспропорционирования
2) 2KMnO4 + 5H₂O₂ + 3H₂SO₄ → 2MnSO₄ + 5O₂ + K₂SO₄ +8H₂O ; межмолекулярная ОВР
Объяснение:
1) I₂ + NaOH → NaI + NaIO₃ + H₂O
5|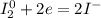 - восстановление (окислитель - I₂)
- восстановление (окислитель - I₂)
1|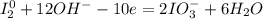 - окисление (восстановитель - I₂)
- окисление (восстановитель - I₂)

Добавляем к каждому аниону натрий:
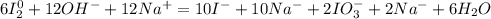
Получаем:
6I₂ + 12NaOH →10 NaI + 2NaIO₃ + 6H₂O
Тип ОВР - реакция диспропорционирования (I₂ выступает и в роли окислителя, и в роли восстановителя)
2) KMnO4 + H₂O₂ + H₂SO₄ → MnSO₄ + O₂ + K₂SO₄ +H₂O
2| - восстановление (окислитель - KMnO4)
- восстановление (окислитель - KMnO4)
5| - окисление (восстановитель - H₂O₂ )
- окисление (восстановитель - H₂O₂ )
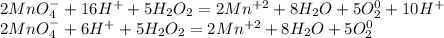
Добавляем к каждому аниону калий, а катиону - SO₄:

Получаем:
2KMnO4 + 5H₂O₂ + 3H₂SO₄ → 2MnSO₄ + 5O₂ + K₂SO₄ +8H₂O
Тип ОВР - межмолекулярная ОВР (окислитель и восстановитель - разные вещества)
2. Молекулярная химическая формула: килсород О2, озон О3
3. Агрегатное состояние, цвет, запах, растворимость в воде
Кислород при нормальных условиях — газ без цвета, вкуса и запаха, слабо растворяется в воде (4,9 мл/100г при 0 °C, 2,09 мл/100г при 50 °C)
Озон при нормальных условиях - газ голубого цвета со специфическим запахом. Растворимость в воде при 0 °C - 0,394 кг/куб. м; (0,494 л/кг) , она в 10 раз выше по сравнению с кислородом.
4. Химическая активность
Обе модификации - окислители, но озон намного сильнее
Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры. Озон - мощный окислитель, намного более реакционно чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины и иридия) до их высших степеней окисления. Окисляет многие неметаллы.
5. Нахождение в природе
Кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов) , приходится около 47,4 % массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 % (по массе) , в атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,12 % по массе. Более 1500 соединений земной коры в своем составе содержат кислород.
Озон образуется во многих процессах, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т. п.
При облучении воздуха жёстким ультрафиолетовым излучением образуется озон. Тот же процесс протекает в верхних слоях атмосферы, где под действием солнечного излучения образуется и поддерживается озоновый слой.
Атмосферный озон играет важную роль для всего живого на планете. Образуя озоновый слой в стратосфере он защищает растения и животных от жёсткого ультрафиолетового излучения. Поэтому проблема образования озоновых дыр имеет особое значение. Однако тропосферный озон является загрязнителем, который может угрожать здоровью людей и животных, а также повреждать растения.