Привет
Начнем с конца.
CuSO4+ 2NaOH = Cu(OH)2 + Na2SO4
m(р-ра) = 48 г
w(р-ра) = 10%
m(CuSO4) = 48×0.1= 4.8 грамм
n(CuSO4) = 4.8/160= 0.03 моль
Так как CuSO4 и NaOH находятся в молярном соотношении 1 к 2, то следует:
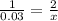
x= 0.06 моль NaOH
При электролизе раствора NaOH выделяется 3 моль газов (2H2 и O2) , но по задаче даётся 134.4 литра
Газы выделяются потому что электролизуется Вода
NaOH не электролизуется
2H2O =(электролиз) 2H2 + O2
При электролизе 2 моль воды, выделятся и улетучивается 3 моль газов, но по задаче даётся 134.4 литра, а это 134.4/22.4 = 6 моль газов
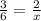
x= 4 моль воды электролизовалось
120×0.1= 12 грамм NaOH
120-12= 108 грамм воды
Так как 72 грамм воды электролизовалось (4×18=72), масса раствора оказалась: 120-72 = 48 грамм
В растворе содержится 12 грамм NaOH
Моль NaOH = 12/40 = 0.3 моль
На осаждение CuSO4 использовали 0.06 моль NaOH
m(NaOH) = 0.06 × 40= 2.4 грамм
Вопрос задачи: Вычислите какую часть (%) раствора использовались для осаждения CuSO4
Масса раствора была 48 грамм - это 100%, 2.4 грамм - X
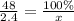
x= 5%
ответ: 5%
Если будут вопросы, отпишитесь в комментариях
ответ:Марганец встречается в природе в основном в виде соединений: пиролюзита MnO_2, марганцевого шпата MnCO_3, танталита (Ta_2Mn^{II})O_6, гаусманита Mn_3O_4, а также известны калиевые и аммониевые соединения марганца.
Реакции на катион марганца Mn^{2+}:
— реакция с раствором щелочи KOH или NaOH. Щелочи с катионами Mn^{2+} белый осадок гидроксида марганца (II), который на воздухе буреет вследствие окисления Mn^{2+} до Mn(IV) с образованием осадка марганцовистой кислоты MnO(OH)_2 (или H_2MnO_3).
— реакция окисления катионов Mn^{2+} до MnO_4^{-}-ионов (характерная реакция). Эту реакцию проводят в кислой среде, при этом окисление Mn^{2+} сопровождается характерной переменой окраски раствора: почти бесцветные соединения марганец (II) окисляются в марганцовую кислоту HMnO_4 фиолетово-розовой окраски. Практически реакцию проводят в азотнокислой среде в присутствии катализатора agNO_3. В качестве окислителей чаще всего используют диоксид свинца, висмутат натрия, персульфат аммония.
— окисление катионов Mn^{2+} персульфатом аммония (NH_4)_2S_2O_8. Наблюдается окрашивание раствора в фиолетовый цвет. При проведении этой реакции в исследуемом растворе не должны содержаться хлорид-ионы (и другие восстановители), так как они восстанавливают ион MnO_4^{-} до H_2MnO_3 или даже до Mn^{2+}.
В ходе взаимодействия гидроксида марганца (II) с разбавленной хлороводородной кислотой (Mn(OH)2 + HCl =?) образуется хлорид марганца (II) и вода. Молекулярное уравнение реакции имеет вид:
\[Mn(OH)_2 + 2HCl_{dilute} \rightarrow MnCl_2 + 2H_2O.\]
Объяснение:
2) mno
3)mn2o7
4) cro
5) cr2o3
6) cr2o6